Unterschied zwischen Tonizität und Osmolarität
Der Schlüsselunterschied zwischen Tonizität und Osmolarität ist, dass die Tonizität misst nur die Konzentration von nicht penstierenden Stoffen durch eine semipermazierende Membran Die Osmolarität misst die Gesamtkonzentration von durchdringenden und nicht penstierenden gelösten Stoffen.
Osmolarität ist das Maß für den osmotischen Druck einer Lösung. Einfacher ist es ungefähr das Maß für die Menge an gelösten Stoff in der Lösung. Im Gegenteil, die Tonizität bezieht sich auf die relative Konzentration von Partikeln gelöster Partikel in einer Zelle in Bezug auf die Konzentration außerhalb der Zelle. So scheinen sowohl Tonizität als auch Osmolarität ähnliche Konzepte zu sein. Es gibt jedoch Unterschiede, die wir in diesem Artikel diskutieren werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Tonizität?
3. Was ist Osmolarität
4. Nebenseitiger Vergleich - Tonizität gegen Osmolarität in tabellarischer Form
5. Zusammenfassung
Was ist die Tonizität??
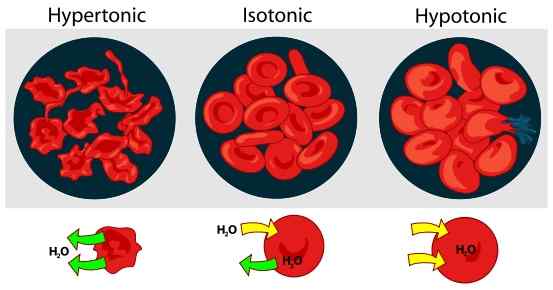
Die Tonizität ist ein Maß für den osmotischen Druckgradienten durch Wasserpotential zweier Lösungen, die durch eine semipermeable Membran getrennt sind. Es bedeutet; Der Begriff Tonizität beschreibt die relative Konzentration der Lösung von gelösten Lagen, die die Richtung und das Ausmaß der Diffusion bestimmt. Diese Messung ist wichtig, um die Reaktion von Zellen zu bestimmen, die in eine externe Lösung eingetaucht sind.

Abbildung 01: Wirkung der Tonizität auf rote Blutkörperchen in einer externen Lösung
Im Gegensatz zum osmotischen Druck wird die Tonizität nur durch gelöste Stoffe beeinflusst, die nicht durch die Membran gehen können. Die gelösten gelösten Stoffe, die die Membran frei durchlaufen können. Es liegt daran, dass die Konzentration dieser gelösten Stoffe auf beiden Seiten der Membran immer gleich bleibt. Normalerweise drücken wir die Tonizität in Bezug auf eine andere Lösung aus. Dementsprechend gibt es drei Arten von Lösungen, die auf der Tonizität basieren. Hypertonische Lösungen, hypotonische Lösungen und isotonische Lösungen. Die hypertonischen Lösungen haben eine hohe Konzentration mit hohem Stoff als eine andere Lösung. Eine Lösung wird isotonisch, wenn die effektive Osmolkonzentration dieser Lösung die gleiche ist wie die einer anderen Lösung.
Was ist Osmolarität?
Osmolarität oder osmotische Konzentration ist ein Maß für die Konzentration der gelösten Stoffe, die durch die Einheit Osmole von gelösten gelösten Literien pro Liter der Lösung angegeben sind. Wir können das Gerät als OSM/L bezeichnen. Ebenso können wir diesen Wert verwenden, um den osmotischen Druck einer Lösung zu messen. So auch die Tonizität der Lösung. Die Gleichung, die wir verwenden können, um diesen Parameter zu messen, lautet wie folgt:
Osmolarität = ∑ckerichNichCich
Hier ist ψ der osmotische Koeffizient, n ist die Anzahl der Partikel, in die ein Molekül disoziiert, und C ist die molare Konzentration des gelösten Stoffes. Ebenso gibt es drei Arten von Lösungen nach Osmolarität; isosmotisch, hyperosmotisch und hypoosmotisch.
Was ist der Unterschied zwischen Tonizität und Osmolarität?
Die Begriffe Tonizität und Osmolarität sind verwandte, aber unterschiedliche Konzepte. Der Grund, warum sie miteinander verwandt sind. Diese Begriffe unterscheiden. Daher besteht der Schlüsselunterschied zwischen Tonizität und Osmolarität darin, dass die Tonizität nur die Konzentration von nicht penetrierenden Stoffen durch eine semipermebare Membran misst, während die Osmolarität die Gesamtkonzentration von Penetrier- und nicht-penetrierenden Stoffen misst.
Die folgende Infografik gibt weitere Fakten zum Unterschied zwischen Tonizität und Osmolarität.

Zusammenfassung -Tonizität gegen Osmolarität
Die Begriffe Osmolarität und Tonizität sind miteinander verbunden, da beide Begriffe die gelösten Konzentrationen in einer Lösung vergleichen. Gleichzeitig sind die Begriffe jedoch unterschiedliche chemische Konzepte entsprechend den Arten von gelösten gelösten, die sie in ihren Messungen berücksichtigen. Daher besteht der Schlüsselunterschied zwischen Tonizität und Osmolarität darin, dass die Tonizität nur die Konzentration nicht penetrierender gelöster Stoffe durch eine semipermeable Membran misst, während die Osmolarität die Gesamtkonzentration von Penetrier- und nicht penstierenden gelösten Stoffen misst.
Referenz:
1. „Tonizität.”Wikipedia, Wikimedia Foundation, 8. Februar. 2018. Hier verfügbar
2. „Osmotische Konzentration.Wikipedia, Wikimedia Foundation, 15. Oktober. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Osmotischer Druck auf Blutzellendiagramm" von Ladyofhats - eigene Arbeit (Public Domain) über Commons Wikimedia


