Unterschied zwischen Typ 1 und 2 Kollagen

Schlüsselunterschied - Typ 1 vs 2 Kollagen
Kollagen ist ein faseriges Protein, das in Bindegeweben, Haut, Knochen usw. gefunden wird. Es bietet Stärke und Festigkeit für verschiedene Körperteile. Kollagen verfügt über eine komplexe Struktur, die aus drei Polypeptidketten besteht, die in Triple Helix -Konfiguration verpackt sind. Es gibt verschiedene Arten von Kollagenproteinen im Körper. Unter ihnen sind Typ 1, 3 und 2 reichlich vorhanden. Typ -1 -Kollagen ist das am häufigsten vorkommende Kollagen bei Säugetieren und befindet sich in Haut, Sehnen, Bändern und Knochen. Typ 2 ist das am häufigsten vorkommende Kollagen im Knorpel. Dies ist der Schlüsselunterschied zwischen Typ 1 und 2 Kollagen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Kollagen
3. Was ist Typ -1 -Kollagen
4. Was ist Typ -2 -Kollagen
5. Seite an Seitenvergleich - Typ 1 gegen 2 Kollagen
6. Zusammenfassung
Was ist Kollagen?
Kollagen ist ein wichtiges strukturelles Protein, das in der extrazellulären Matrix der verschiedenen Bindegewebe bei Tieren und Menschen vorkommt. Es ist das am häufigsten vorkommende Protein bei Säugetieren. Kollagen existiert in Form langer dünner Fibrillen, die sehr hart und unlöslich sind. Es verfügt über drei Polypeptidstränge. Jede Polypeptidkette enthält etwa 1000 Aminosäuren, die aus Glycin, Prolin und Hydroxyprolin bestehen. Glycin befindet. X und y sind hauptsächlich von Prolin und Hydroxyprolin besetzt. Daher sind Glycin-Prolin-Hydroxyprolinsequenzen in Kollagenfibrille reichlich vorhanden.
Kollagene werden von der Genfamilie col codiert, und es gibt 45 verschiedene kollagenkodierende Gene in dieser Familie. Es gibt ungefähr sechzehn verschiedene Kollagentypen. Unter ihnen sind Typ 1, 2 und 3 häufiger vorhanden. Diese Typen variieren mit dem Zusammenbau von Polypeptidketten, der Länge der Helix, Unterbrechungen in der Helix und Unterschieden in den Kündigungen der Helixe usw.
Die Kollagensynthese wird durch Vitamin C beeinflusst, da sie für die Produktion von Hydroxyprolin -Aminosäuren im Kollagenfibrille erforderlich ist. Die Kollagenproduktion verringert sich mit dem Altern. Es wird auch durch die Exposition gegenüber ultravioletten Strahlung und einigen anderen Umweltfaktoren beeinflusst. Einige Bakterien und Viren können auch Kollagen abbauen und die Kollagensynthese beeinträchtigen. Der Kollagenspiegel wird aufgrund von Rauchen, Autoimmunerkrankungen, Sonnenlicht, hohem Zuckerverbrauch usw. verringert.
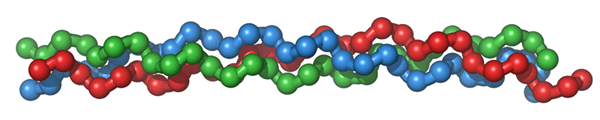
Abbildung 01: Dreifachhelixstruktur von Kollagen
Was ist Typ -1 -Kollagen?
Typ -1 -Kollagen ist das häufigste Kollagen im Körper. Es macht ca. 90% des gesamten Kollagen im Körper. Es ist in verschiedenen Körperteilen wie Haut, Sehne, Gefäßligatur, Organen, Knochen usw. weit verbreitet. Es war das erste Kollagen, das aufgrund seiner Fülle in der extrazellulären Matrix und der Leichtigkeit der Isolation charakterisiert wurde. Es hat zwei Alpha1 -Ketten und eine Alpha2.

Abbildung 02: Fibrillen von Kollagen Typ 1
Was ist Typ -2 -Kollagen?
Typ -2 -Kollagen ist die Hauptkomponente der extrazellulären Matrix des Knorpels. Es macht 50% des Knorpelproteins aus. Typ -2. Kollagen 2 findet sich auch in Wirbelscheiben, innerem Ohr und Glaskörper. Collagen 2 besteht aus drei Pro -Alpha1 -Ketten. Das Col2A1 -Gen ist für die Expression des Typ -2 -Kollagens im Körper kodiert. Typ -2 -Kollagensynthese wird mit dem Alter reduziert und als orale Nahrungsergänzungsmittel für die Gesundheit von Gelenk und Knorpel angesehen.
Was ist der Unterschied zwischen Typ 1 und 2 Kollagen?
Typ 1 gegen 2 Kollagen | |
| Typ -1 -Kollagene sind die am häufigsten vorkommenden Kollagenentypen. | Typ -2 -Kollagene sind die dritthäufigsten Kollagentypen. |
| Ort im Körper | |
| Sie sind am häufigsten in Haut, Sehne, Gefäßligatur, Organen und Knochen vorhanden. | Sie sind am häufigsten in Knorpeln. |
| Fibrillendurchmesser | |
| Fibrillen haben einen größeren Durchmesser als Typ -2 -Fibrillen. | Fibrillen haben einen geringeren Durchmesser als diejenigen in Typ 1. |
| Natur | |
| Diese sind von Seite an Seite gepackt und machen dicke Fibrillen. | Diese sind zufällig in der Proteoglycan -Matrix des Knorpels ausgerichtet. |
| Als Nahrungsergänzungsmittel verwenden | |
| Sie können mit Typ -3 -Kollagen gemischt werden und Ergänzungen für Haut, Muskeln und Knochen herstellen | Sie können als orale Nahrungsergänzungsmittel für gemeinsame und Knorpelgesundheit angesehen werden. |
| Gen codiert | |
| Col1a1 | Col2a1 |
Zusammenfassung -Typ 1 gegen 2 Kollagen
Kollagen ist das am häufigsten vorkommende strukturelle Protein im Körper des Säugetiers, das ca. 25% des gesamten Proteins. Es ist ein unlösliches faseriges Protein, das Haut, Nägeln, Muskeln, Gelenken und Knochen des Körpers Flexibilität und Kraft verleiht. Kollagen existiert in 16 verschiedenen Typen, und die meisten reichlich vorhanden sind Typ 1, 2 und 3. Collagen Triple Helix besteht aus drei Polypeptidketten, die mit Gly-X-Y-Aminosäuren-Wiederholungen sequenziert wurden. Typ -1 -Kollagen ist der am häufigsten vorkommende Typ im Körper und befindet sich in Haut, Sehne, Gefäßligatur, Organen und Knochen. Typ -2 -Kollagen ist das Hauptkollagen im Knorpel.
Referenz:
1. „Strukturproteine: Gene für Kollagen.”Enzyklopädie der Biowissenschaften. N.P., N.D. Netz. 08 März. 2017.
2.”Col1a1 Collagen Typ I Alpha 1 -Kette [Homo Sapiens (Human)] - Gen - NCBI.Nationales Zentrum für Biotechnologieinformationen. U.S. Nationalbibliothek für Medizin, n.D. Netz. 08 März. 2017
3. Lodisch, Harvey. „Kollagen: Die faserigen Proteine der Matrix.”Molekulare Zellbiologie. 4. Ausgabe. U.S. Nationalbibliothek für Medizin, 01. Januar. 1970. Netz. 08 März. 2017
Bild mit freundlicher Genehmigung:
1. "Fasern von Kollagen Typ I - Tem" von Louisa Howard - (Public Domain) über Commons Wikimedia
2. "Collagentripipehelix" (CC BY-SA 3.0) über Commons Wikimedia


