Unterschied zwischen Valenz und Kernelektronen
Der Schlüsselunterschied Zwischen Wertigkeit und Kernelektronen ist das Valenzelektronen beteiligen sich an chemischen Bindungsformationen, während Kernelektronen dies nicht tun.
Atome sind die Bausteine aller vorhandenen Substanzen. Sie sind so winzig, dass wir sie nicht einmal mit unserem bloßen Auge beobachten können. Im Allgemeinen befinden sich Atome im Angstrombereich. Atom besteht aus einem Kern, der Protonen und Neutronen hat. Es gibt Elektronen, die in Orbitalen um den Kern kreisen. Der größte Teil des Raums in einem Atom ist leer. Die attraktiven Kräfte zwischen dem positiv geladenen Kern (positive Ladung durch Protonen) und den negativ geladenen Elektronen beibehalten die Form des Atoms. Elektronen wohnen in Orbitalen als Paare in Atomen, und sie haben entgegengesetzte Spins. Darüber hinaus gibt es zwei Arten von Elektronen als Valenzelektronen und Kernelektronen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Valenzelektronen
3. Was sind Kernelektronen
4. Seite für Seitenvergleich - Valenz gegen Kernelektronen in tabellarischer Form
5. Zusammenfassung
Was sind Valenzelektronen?
Valenzelektronen sind die Elektronen in einem Atom, das an der Bildung chemischer Bindungen beteiligt ist. Wenn sich Chemikalienbindungen bilden, kann ein Atom entweder Elektronen gewinnen, Elektronen spenden oder Elektronen teilen. Die Fähigkeit, diese Elektronen zu spenden, zu gewinnen oder zu teilen, hängt von der Anzahl der Valenzelektronen ab, die sie haben. Zum Beispiel wenn ein h2 Es entsteht Molekül, ein Wasserstoffatom verleiht der kovalenten Bindung ein Elektron. Somit teilen sich zwei Atome zwei Elektronen. Daher hat ein Wasserstoffatom ein Valenzelektron. Bei der Bildung von Natriumchlorid gibt ein Natriumatom ein Elektron aus, während ein Chloratom ein Elektron nimmt. Es geschieht, um ein Oktett in ihren Valenzorbitalen zu füllen. Dort hat Natrium nur ein Valenzelektron und Chlor hat sieben. Durch die Betrachtung der Valenzelektronen können wir daher die chemische Reaktivität der Atome bestimmen.
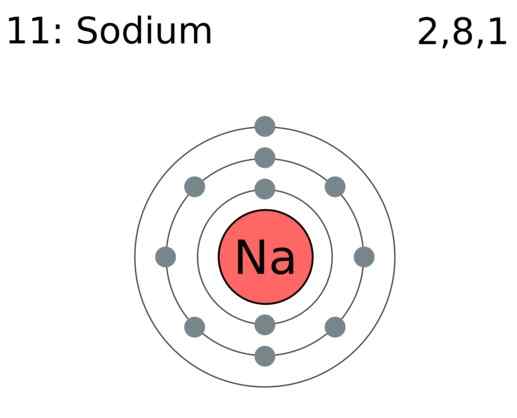
Abbildung 01: Natriumatom hat ein Valenzelektron
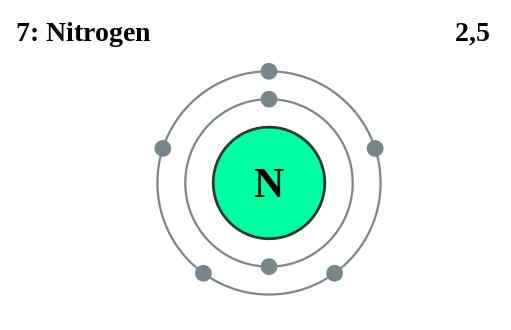
Hauptgruppenelemente (Gruppe I, II, III usw.) haben Valenzelektronen in den äußersten Schalen. Die Anzahl der Valenzelektronen entspricht ihrer Gruppennummer. Inertatome haben Schalen mit der maximalen Anzahl von Valenzelektronen abgeschlossen. Für Übergangsmetalle fungieren einige innere Elektronen auch als Valenzelektronen. Die Anzahl der Valenzelektronen kann durch Betrachtung der Elektronenkonfiguration des Atoms bestimmt werden. Zum Beispiel hat Stickstoff die Elektronenkonfiguration von 1s2 2s2 2p3. Die Elektronen in der 2nd Schale (die in diesem Fall die höchste Hauptquantenzahl ist) werden als Valenzelektronen genommen. Daher hat Stickstoff fünf Valenzelektronen. Neben der Teilnahme an der Bindung sind Valenzelektronen der Grund für die thermische und elektrische Leitfähigkeit von Elementen.
Was sind Kernelektronen?
Kernelektronen sind andere Elektronen als Valenzelektronen des Atoms. Da sich diese Elektronen an inneren Stellen des Atoms befinden, beteiligen sich die Kernelektronen nicht an der Bildung von Bindungen. Sie wohnen in Innenschalen eines Atoms. Zum Beispiel in einem Stickstoffatom (1s2 2s2 2p3) fünf Elektronen aus allen sieben sind Valenzelektronen, während zwei 1S -Elektronen Kernelektronen sind.

Abbildung 02: Stickstoff hat zwei Kernelektronen
Darüber hinaus ist die Energie, die zum Entfernen eines Kernelektrons aus einem Atom erforderlich ist, extrem höher als die für Valenzelektronen erforderliche Energie.
Was ist der Unterschied zwischen Valenz und Kernelektronen?
Sowohl Valenzelektronen als auch Kernelektronen bewegen sich um den Kern eines Atoms. Valenzelektronen befinden sich an den äußersten Elektronenschalen, während sich Kernelektronen in den Innenschalen befinden. Beispielsweise hat ein Stickstoffatom 5 Valenzelektronen und 2 Kernelektronen gemäß der Elektronenkonfiguration; 1s2 2s2 2p3. Aboveall, der Hauptunterschied zwischen Valenz und Kernelektronen besteht darin.
Ein weiterer signifikanter Unterschied zwischen Valenz und Kernelektronen besteht darin, dass die zur Entfernung von Kernelektronen erforderliche Energie im Vergleich zu der Energie, die zum Entfernen von Valenzelektronen erforderlich ist, sehr hoch ist.
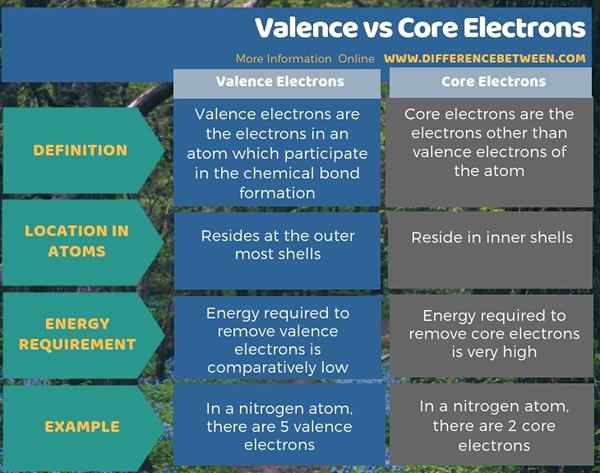
Zusammenfassung -Valenz gegen Kernelektronen
Es gibt zwei Elektronenarten in einem Atom als Valenzelektronen und Kernelektronen. Valenzelektronen befinden sich an den äußersten Schalen, während sich Kernelektronen in den Innenschalen befinden. Der Hauptunterschied zwischen Valenz und Kernelektronen besteht darin, dass Valenzelektronen an der Bildung chemischer Bindungen teilnehmen, während Kernelektronen dies nicht tun.
Referenz:
1. “1.3: Valenzelektronen und offene Valences.”Chemie libretexten, libretexten, 23 April. 2019, hier erhältlich.
2. “1.9b: Valenz- und Kernelektronen.”Chemistry Libretexten, Libretexte, 2. Mai 2019, hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Electron Shell 011 Natrium" von Greg Robson - Anwendung: Inkscape (CC BY -SA 2.0 uk) über Commons Wikimedia
2. „Elektronenschale 007 Stickstoff“ Par Pumbaa (Originalarbeit von Greg Robson) - Datei: Elektronenschale 007 Stickstoff.PNG (CC BY-SA 2).0 uk) über Commons Wikimedia


