Unterschied zwischen Valenzschale und vorletzter Schale
Der Schlüsselunterschied Zwischen Valenzschale und vorletzter Schale ist das Valenzschale ist die äußerste elektronenhaltige Hülle eines Atoms, während vorletzte Hülle die Hülle ist.
Die Begriffe Valenzschale und vorletzte Schale werden hauptsächlich in der allgemeinen Chemie verwendet, wenn die Elektronenzusammensetzung eines bestimmten Atoms bestimmen. Valenzschale und vorletzte Schale enthalten eine oder mehrere Elektronen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine Valenzschale
3. Was ist eine vorletzte Hülle
4. Nebenseitiger Vergleich - Valenzschale gegen vorletzte Schale in tabellarischer Form
5. Zusammenfassung
Was ist eine Valenzschale?
Eine Valenzschale ist die äußerste elektronenhaltige Hülle eines Atoms. Die Elektronen in dieser Schale werden Valenzelektronen bezeichnet. Dies sind die Elektronen, die die geringste Anziehungskraft auf den Kern eines Atoms haben. Es liegt daran, dass Valenzelektronen im Vergleich zu den anderen Elektronen dieses Atoms weit vom Kern entfernt sind.
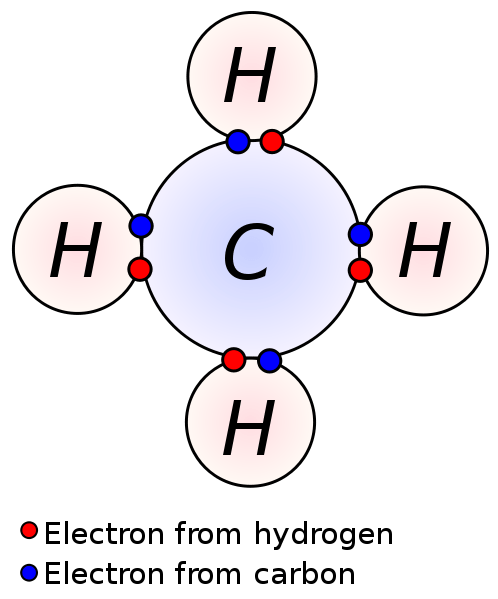
Abbildung 01: Valenzelektronen, die an der Bindungsbildung beteiligt sind
Elektronen in der Valenzschale sind für chemische Reaktionen und chemische Bindungen von Atomen verantwortlich. Da die Anziehungskraft zwischen diesen Elektronen und dem Kern eines Atoms geringer ist, können Valenzelektronen leicht entfernt werden (als die Elektronen in den inneren Orbitalen). Dies ist wichtig für die Bildung von ionischen Verbindungen und kovalenten Verbindungen. Durch den Verlust von Valenzelektronen können Atome Kationen bilden. Das Teilen von Valenzelektronen eines Atoms mit den Valenzelektronen eines anderen Atoms führt zu kovalenten Bindungen.
Für S -Blockelemente und P -Blockelemente sind die Valenzschalen S -Orbitale bzw. P -Orbitale. Für Übergangselemente können jedoch auch die Valenzelektronen in inneren Orbitalen vorhanden sein. Dies ist auf die Energiedifferenz zwischen den Suborbitalen zurückzuführen. Zum Beispiel beträgt die Atomzahl von Mangan (MN) 25. Die Elektronenkonfiguration von Cobalt ist [AR] 3D54s2. Die Valenzelektronen von Kobalt sollten sich im 4S -Orbital befinden. Aber es gibt 7 Valenzelektronen in MN. Die Elektronen im 3D -Orbital gelten auch als Valenzelektronen, da sich das 3D -Orbital außerhalb des 4S -Orbitals befindet (die Energie von 3D ist höher als das 4S -Orbital).
Was ist vorletzte Hülle?
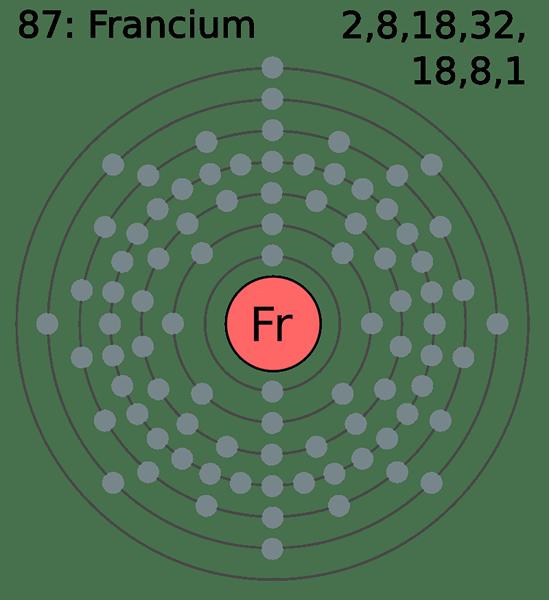
Vorletzte Hülle ist die elektronenhaltige Hülle, die zur äußersten Valenzschale innerlich ist. Mit anderen Worten, es ist die zweite letzte mit Elektronen gefüllte Schale oder die Hülle vor der Valenzschale. Daher verfügt die vorletzte Hülle im Vergleich zur Valenzschale über Elektronen, die mehr vom Atomkern angezogen werden.

Abbildung 02: Francium -Atom mit acht Elektronen in der vorletzten Hülle mit
Darüber hinaus sind Elektronen in der vorletzten Hülle nicht an den chemischen Bindungs- und Verbindungs- und Verbindungsbildungsprozessen beteiligt, da sie von den Valenzschalenelektronen abgedeckt sind. In Übergangsmetallen können die Elektronen in der vorletzten Hülle jedoch die äußersten Elektronen des Metallatoms sein, da die Energien der Suborbitale unterschieden werden.
Was ist der Unterschied zwischen Valenzschale und vorletzter Hülle?
Der Hauptunterschied zwischen Valenzschale und vorletzter Schale besteht darin, dass Valenzschale die äußerste elektronenhaltige Hülle eines Atoms ist. Die vorletzte Hülle ist jedoch diejenige, die in der äußersten elektronenhaltigen Hülle innerlich ist. Daher ist die vorletzte Hülle näher am Atomkern als die Valenzschale.
Darüber hinaus sind die Elektronen in der Valenzschale weniger vom Atomkern angezogen als die Elektronen in der vorletzten Hülle. Abgesehen davon sind die Elektronen in der Valenzschale an der Bildung chemischer Bindung und Verbindungen beteiligt, während Elektronen in der vorletzten Hülle nicht an chemischen Reaktionen beteiligt sind.
Die folgenden Infografik tabelliert die Unterschiede zwischen Valenzschale und vorletzter Hülle.
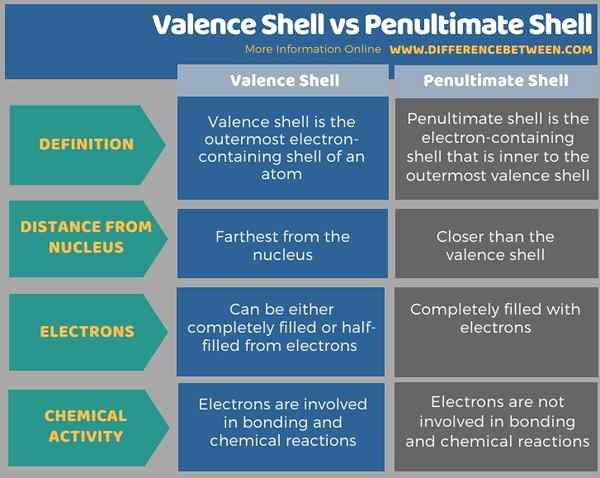
Zusammenfassung -Valenzschale gegen vorletzte Schale
Valenzschale und vorletzte Schale sind zwei chemische Begriffe, die in der allgemeinen Chemie sehr wichtig sind. Der wichtigste Unterschied zwischen Valenzschale und vorletzter Hülle besteht darin, dass Valenzschale die äußerste elektronenhaltige Hülle eines Atoms ist, während vorletzte Schale die Schale ist, die zur äußersten elektronenhaltigen Hülle innerlich ist.
Referenz:
1. Helmenstine, Anne Marie. „Valenzelektronendefinition in der Chemie.”Thoughtco, Februar. 11, 2020, hier erhältlich.
2. "Valenzelektron.”Wikipedia, Wikimedia Foundation, 6. Februar. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Kovalent" von Dynablast - erstellt mit Inkscape (CC BY -SA 2.5) über Commons Wikimedia
2. "Elektronenschale 087 Francium" (CC BY-SA 2.0 uk) über Commons Wikimedia


