Unterschied zwischen Wasser und Eis

Der Schlüsselunterschied Zwischen Wasser und Eis ist das die Wasser hat keine regelmäßige Anordnung von Molekülen, während das Eis eine bestimmte kristalline Struktur hat.
Aus den Anfangsphasen der Evolution der Erde war Wasser ein wesentlicher Teil der Erde. Was heute bedeckt Wasser mehr als 70% der Erdoberfläche. Daraus befindet sich ein größerer Teil Wasser in den Ozeanen und Meeren; Das sind ungefähr 97%. Flüsse, Seen und Teiche haben 0.6% Wasser und etwa 2% sind in polaren Eiskappen und Gletschern da. Eine gewisse Wassermenge ist im Untergrund vorhanden und eine Minute Menge ist in der Gasform als Dämpfe und in Wolken. Darunter gibt es noch weniger als 1% des Wassers für den direkten menschlichen Gebrauch. Dieses reine Wasser wird auch Tag für Tag verschmutzt, und es sollte einen ordnungsgemäßen Plan zur Erhaltung von Wasser geben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Wasser
3. Was ist Eis
4. Seite an Seite Vergleich - Wasser gegen Eis in tabellarischer Form
5. Zusammenfassung
Was ist Wasser?
Wasser ist eine anorganische Verbindung mit der chemischen Formel H2Ö. Wasser ist etwas, ohne das wir nicht leben können. Zwei Hydrlenze verbinden sich kovalent mit einem Sauerstoffatom, um ein Wassermolekül zu bilden. Darüber hinaus erhält das Molekül eine gebogene Form, um die elektronen einsame Paar-Bond-Abstoßung zu minimieren, und der H-O-H-Winkel beträgt 104Ö. Wasser ist eine klare, farblose, geschmacklose, geruchlose Flüssigkeit. Darüber hinaus kann es in verschiedenen Formen wie Nebel, Tau, Schnee, Eis, Dampf usw. sein. Es geht in die Gasphase, wenn sich über 100 erhitzt ÖC beim normalen atmosphärischen Druck.
Wasser ist wirklich ein Wundermolekül. Es ist die am häufigsten vorkommende anorganische Verbindung in lebender Materie. Mehr als 75% unseres Körpers komponieren Wasser. Dort ist es eine Komponente von Zellen, wirkt als Lösungsmittel und Reaktant. Es ist jedoch eine Flüssigkeit bei Raumtemperatur, obwohl es ein niedriges Molekulargewicht von 18 Gmol aufweist-1.

Abbildung 01: Wasser befindet sich in der flüssigen Phase
Die Fähigkeit von Wasser, Wasserstoffbrückenbindungen zu bilden, ist ein einzigartiges Merkmal, das es hat. Dort kann ein einzelnes Wassermolekül vier Wasserstoffbrückenbindungen bilden. Sauerstoff ist elektronegativer als Wasserstoff, was die O-H-Bindungen im Wassermolekül polar macht. Aufgrund der Polarität und der Fähigkeit, Wasserstoffbrückenbindungen zu bilden, ist Wasser ein starkes Lösungsmittel. Darüber hinaus nennen wir es ein universelles Lösungsmittel, da eine große Anzahl von Materialien aufgelöst werden kann. Darüber hinaus hat Wasser eine hohe Oberflächenspannung, einen hohen Klebstoff und kohäsive Kräfte. Es kann Temperaturänderungen standhalten, ohne in das Gas oder die feste Form zu gehen. Wir nennen dies eine hohe Wärmekapazität, was wiederum für das Überleben lebender Organismen wichtig ist.
Was ist Eis?
Eis ist die feste Form des Wassers. Wenn wir Wasser unter 0 nennenÖC Es beginnt zu frieren, Eis zu bilden. Eis ist entweder transparent oder leicht undurchsichtig. Manchmal hat es jedoch eine Farbe, abhängig von den Verunreinigungen, die es enthält. Darüber hinaus hat diese Verbindung eine geordnete reguläre kristalline Struktur.

Abbildung 02: Eis schwimmt auf Wasser
Die Wasserstoffbrückenbindungen sind wichtig, um diese geordnete feste Struktur in Eis zu machen. Die Wasserstoffbrückenbindungen halten das H2O Moleküle mit einem bestimmten Abstand voneinander und bilden eine kristalline Struktur. Während dieses Prozesses das Volumen der gleichen Masse von H2O erweitert sich (was bedeutet, dass die Wassermasse beim Einfrieren von Eis vergleichsweise ein hohes Volumen erhält). Da sich das Wasservolumen beim Einfrieren ausdehnt, ist die Eisdichte niedriger als Wasser. Daher kann es auf Wasser schweben. Dies verhindert, dass das Wasser in den Böden der Gewässer im Winterbereich gefriert und so das Lebensleben schützt.
Was ist der Unterschied zwischen Wasser und Eis?
Eis ist die feste Form von Wasser und hat eine bestimmte kristalline Struktur, aber Wasser hat keine so regelmäßige Anordnung von Molekülen. Dies ist also der Hauptunterschied zwischen Wasser und Eis. Hier ergibt sich dieser Unterschied aufgrund des Vorhandenseins von Wasserstoffbrückenbindungen zwischen den Wassermolekülen. Während des Gefrierprozesses halten die Wasserstoffbrückenbindungen die H2O Moleküle in einem bestimmten Abstand voneinander und verleihen Eis eine kristalline Struktur. Auch dieser Prozess erhöht das Volumen. Daher können wir als ein weiterer wichtiger Unterschied zwischen Wasser und Eis sagen, dass Eis im Vergleich zu Wasser eine geringe Dichte aufweist. Daher kann es auf Wasser schweben.
Außerdem können wir einen Unterschied zwischen Wasser und Eis basierend auf ihrem Volumen und ihrer Dichte ermitteln. Das ist; Bei der gleichen Masse ist das Wasservolumen vergleichsweise niedriger als Eis. Weil die Wasserdichte höher ist als die von Eis. Die folgende Infografik über den Unterschied zwischen Wasser und Eis zeigt mehr Unterschiede zwischen beiden.
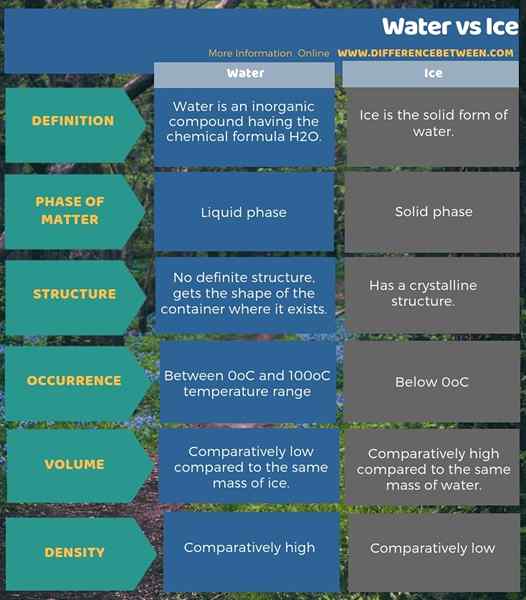
Zusammenfassung -Wasser gegen Eis
Eis ist die feste Form des Wassers. Aufgrund des Vorhandenseins von Wasserstoffbrückenbindungen zwischen den Wassermolekülen bildet sich Eis jedoch mit einer regelmäßigen Anordnung von H2O Moleküle, wenn wir unter 0 abkühlenÖC. Daher besteht der Hauptunterschied zwischen Wasser und Eis darin, dass das Wasser keine regelmäßige Anordnung von Molekülen hat, während das Eis eine bestimmte kristalline Struktur aufweist.
Referenz:
1. „Eis, Wasser und einfache Chemie.”Quatr.US -Studienführer, Verlagsname Quatr.US -Studienführer Publisher Logo, 17. April. 2018. Hier verfügbar
2. Zumdahl, Steven s. "Wasser.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 4. Oktober. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.„Wasserabfall Auswirkungen auf eine Wasseroberfläche - (2)“ von Davide Restivo aus Aarau, Schweiz - Drops #3, (CC BY -SA 2.0) über Commons Wikimedia
2."Wasser und Eis" von Victor Blacus - eigene Arbeit (CC BY -SA 4).0) über Commons Wikimedia


