Was ist der Unterschied zwischen allosterischen und nichtalosterischen Enzymen
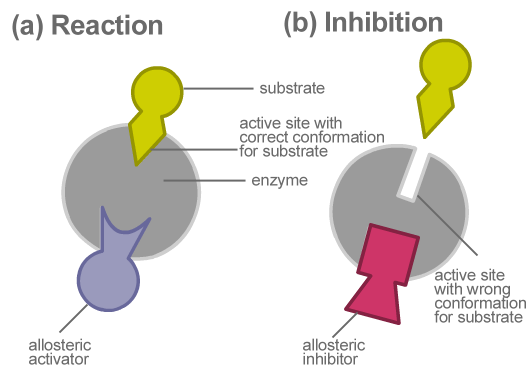
Der Schlüsselunterschied zwischen allosterischen und nicht allosterischen Enzymen ist, dass allosterische Enzyme andere allosterische Stellen als ihre aktiven Stellen für die Bindung von regulatorischen Molekülen haben, während nicht allosterische Enzyme nur ein aktives Zentrum haben, um an das Substrat zu binden.
Es gibt verschiedene Arten der Enzymregulation. Die allosterische Regulation ist eine solche Form der Enzymregulation. Die allosterische Regulierung wird durch Enzyme erleichtert, die als allosterische Enzyme bezeichnet werden. Regulatorische Moleküle binden an allosterische Stellen, die vom Enzym besessen sind und die enzymatische Aktivität regulieren. Daher werden allosterische Enzyme auch als regulatorische Enzyme bezeichnet. Die Spezialität der allosterischen Enzyme ist, dass sie andere Standorte als das wichtigste aktive Zentrum besitzen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind allosterische Enzyme
3. Was sind nicht allosterische Enzyme
4. Ähnlichkeiten - allosterische gegen nicht allosterische Enzyme
5. Allosterische gegen nicht allosterische Enzyme in tabellarischer Form
6. Zusammenfassung - allosterische gegen nicht allosterische Enzyme
Was sind allosterische Enzyme?
Allosterische Enzyme sind eine Art Enzym, das allosterische Stellen zur Bindung von regulatorischen Molekülen besitzt. Diese Stellen befinden sich in den verschiedenen Proteinuntereinheiten des Enzyms. Ein regulatorisches Molekül kann ein Inhibitor oder ein Aktivator sein. Wenn ein Inhibitor an das Enzym bindet, nimmt die Enzymaktivität ab. Wenn ein Aktivator an das Enzym bindet, nimmt die enzymatische Funktion zu. Diese Art der Regulation der enzymatischen Aktivität wird als allosterische Regulation bezeichnet. Ein allosterisches Enzym ist spezifisch für sein Substrat und seine regulatorischen Moleküle (Modulatoren). Die Wechselwirkung des regulatorischen Moleküls/Modulators mit dem Enzym ist reversibel und nichtkovalent. Eine durch ein allosterische Enzym katalysierte Reaktion zeigt eine sigmoidale Kurve.

Abbildung 01: Allosterische Hemmung
Die allosterische Regulierung findet als Rückkopplungsmechanismus statt. Bei der negativen Rückkopplungshemmung ist das regulatorische Molekül ein Inhibitor und hemmt die Reaktion. In einem positiven Rückkopplungsmechanismus erhöht ein Effektormolekül oder ein Aktivator, das an die allosterische Stelle bindet, die Reaktionsgeschwindigkeit. Die Bindung des allosterischen Modulators an ein allosterisches Enzym verändert die Konformation des Proteins und beeinflusst so seine Funktion. Pyruvatkinase, Ribonukleotidreduktase, Aspartat-Transcarbamoylase und ADP-Glucose-Pyrophosphorylase sind mehrere Beispiele für allosterische Enzyme.
Was sind nicht allosterische Enzyme?
Nichtalosterische Enzyme sind die Enzyme, die nicht allosterische Stellen als das aktive Zentrum verarbeiten. Daher sind es einfache Enzyme, die nur ein enzymaktives Zentrum haben. Diese Enzyme sind substratspezifische Enzyme. Sie sind auch nicht regulatorische Enzyme. Ihre Reaktionen zeigen eine hyperbolische Kurve.
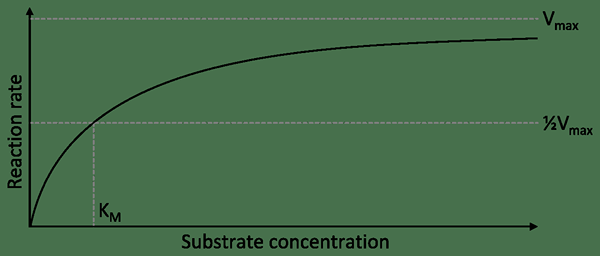
Abbildung 02: Hyperbolische Kurve, die durch ein nicht allosterisches Enzym gezeigt wird
Wenn es einen kompetitiven Inhibitor gibt, nimmt die Reaktionsgeschwindigkeit ab. Ein Wettbewerbsinhibitor ähnelt dem Substrat. Daher konkurriert es mit dem Substrat um die Bindung an das aktive Zentrum. Wenn das Substrat nicht an das aktive Zentrum binden, kann der Substrat-Enzymkomplex nicht gebildet werden, so dass die Reaktionsgeschwindigkeit abnimmt.
Was sind die Ähnlichkeiten zwischen allosterischen und nichtalosterischen Enzymen?
- Allosterische und nicht allosterische Enzyme sind zwei Arten von Enzymen.
- Sie bestehen aus Proteinen.
- Sie katalysieren biochemische Reaktionen in lebenden Zellen.
- Beide Arten von Enzymen bleiben am Ende der Reaktion unverändert.
- Eine kleine Konzentration dieser Enzyme reicht aus, um eine Reaktion zu katalysieren.
- Sie reagieren empfindlich gegenüber Änderungen von pH und Temperatur.
Was ist der Unterschied zwischen allosterischen und nichtalosterischen Enzymen?
Ein allosterisches Enzym ist ein Enzym mit einer zusätzlichen Stelle, die als regulatorische Stelle oder allosterische Stelle für die Bindung eines regulatorischen Moleküls bezeichnet wird. Ein nicht allosterisches Enzym ist ein einfaches Enzym, das nur ein aktives Zentrum für die Bindung seines Substrats hat. Dies ist also der Hauptunterschied zwischen allosterischen und nicht allosterischen Enzymen.
Die folgende Infografik listet die Unterschiede zwischen allosterischen und nichtalosterischen Enzymen in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung -allosterische gegen nicht allosterische Enzyme
Das allosterische Enzym ist ein regulatorisches Enzym, das eine andere allosterische Stelle als die aktive Stelle besitzt. Daher kann ein regulatorisches Molekül an die allosterische Stelle binden und die enzymatische Aktivität regulieren. Im Gegensatz dazu hat das nicht allosterische Enzym keine allosterische Stelle. Es hat nur ein aktives Zentrum. Nichtalosterische Enzyme sind keine regulatorischen Enzyme. Allosterische Enzyme sind sowohl substrat- als auch regulatorisches Molekül spezifisch, während nicht allosterische Enzyme substratspezifisch sind. Dies ist daher die Zusammenfassung des Unterschieds zwischen allosterischen und nichtalosterischen Enzymen.
Referenz:
1. „Enzymregulation (Artikel)." Khan Akademie.
2. „Enzyme.”Lumen.
Bild mit freundlicher Genehmigung:
1. "Allosterische Hemmung" von [[: en: Benutzer: 1 | 1] an der englischsprachigen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia
2. "Michaelis Menteen Curve 2" von Thomas Shafee - eigene Arbeit (CC von 4.0) über Commons Wikimedia


