Was ist der Unterschied zwischen dem Phasenübergang erster und zweiter Ordnung
Der Schlüsselunterschied zwischen Phasenübergang erster und zweiter Ordnung Ist die Phasenübergänge erster Ordnung von der ersten Leistung der Reaktantenkonzentration in einer Geschwindigkeitsgleichung abhängig, während Phasenübergänge zweiter Ordnung von der zweiten Leistung der Konzentration in der Geschwindigkeitsgleichung abhängen.
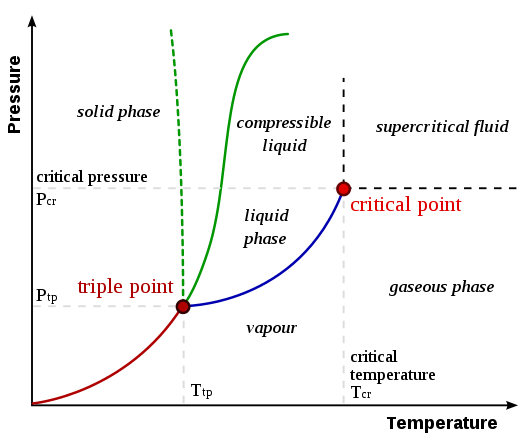
Ein Phasenübergang ist eine Veränderung der Phase der Materie, die ein physikalischer Prozess des Übergangs eines Zustands eines Mediums in einen anderen Zustand desselben Mediums ist, der durch Parameter wie Dichte und Volumen identifiziert wird. Im Allgemeinen wird dieser Begriff verwendet, um Phasen wie Feststoff, Flüssigkeit, Gas und Plasma zu beschreiben. Die Arten von Phasenübergängen umfassen Schmelzen, Kochen, Sublimation, Verdampfung, Ionisierung, Ablagerung, Kondensation und Rekombination.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist der Phasenübergang erster Ordnung
3. Was ist Phasenübergang zweiter Ordnung
4. Erster gegen Phasenübergang zweiter Ordnung in tabellarischer Form
5. Zusammenfassung -Erster gegen Phasenübergang zweiter Ordnung
Was ist der Phasenübergang erster Ordnung?
Phasenübergänge erster Ordnung sind chemische Reaktionen, bei denen die Reaktionsgeschwindigkeit von der molaren Konzentration eines der an der Reaktion beteiligten Reaktanten abhängt. Daher wird die Summe der Mächte, auf die die Reaktantenkonzentrationen in der Ratenrechtsgleichung erhöht werden, immer 1 sein. Wenn ein einzelner Reaktant an diesen Reaktionen teilnimmt, bestimmt die Konzentration dieses Reaktanten die Reaktionsgeschwindigkeit. Aber manchmal gibt es mehr als einen Reaktanten, der an diesen Reaktionen teilnimmt. In solchen Fällen bestimmt einer dieser Reaktanten die Reaktionsgeschwindigkeit.

Wir können einen Phasenübergang erster Ordnung durch die Diskontinuität thermodynamischer Variablen, einschließlich Dichte und Entropie, charakterisieren. Darüber hinaus wird diese Art von Übergang normalerweise durch Volumenänderungen angezeigt.
Was ist Phasenübergang zweiter Ordnung?
Phasenübergänge zweiter Ordnung sind chemische Reaktionen, bei denen die Reaktionsgeschwindigkeit von der molaren Konzentration von zwei der Reaktanten oder der zweiten Leistung eines an der Reaktion beteiligten Reaktanten abhängt. Daher wird die Summe der Mächte, auf die die Reaktantenkonzentrationen in der Ratenrechtsgleichung erhöht werden, immer 2 sein. Wenn es zwei Reaktanten gibt, hängt die Reaktionsgeschwindigkeit von der ersten Leistung der Konzentration jedes Reaktanten ab.
Ein Übergang der zweiten Phase wird auch als kontinuierlicher Phasenübergang bezeichnet, da er durch eine unterschiedliche Anfälligkeit, ein Verfall der Korrelationen in der Nähe von Kritikalität usw. gekennzeichnet ist, usw. Die Theorie hinter den Phasenübergängen der zweiten Ordnung wurde von Wissenschaftlern entwickelt, die die Landau -Theorie nutzten.
Was ist der Unterschied zwischen dem Phasenübergang erster und zweiter Ordnung?
Reaktionen erster Ordnung und zweite Ordnung können als Phasenübergänge auftreten. Der Schlüsselunterschied zwischen Phasenübergang in erster und zweiter Ordnung besteht darin, dass Phasenübergänge erster Ordnung von der ersten Leistung der Reaktantenkonzentration in einer Geschwindigkeitsgleichung abhängen, während Phasenübergänge zweiter Ordnung von der zweiten Leistung der Konzentration in der Geschwindigkeitsgleichung abhängen.
Im Folgenden finden Sie eine Zusammenfassung der Differenz zwischen dem Phasenübergang erster und zweiter Ordnung in tabellarischer Form für den Nebeneinander-Vergleich.
Zusammenfassung -Erster gegen Phasenübergang zweiter Ordnung
Phasenübergänge erster Ordnung sind chemische Reaktionen, bei denen die Reaktionsgeschwindigkeit von der molaren Konzentration eines der an der Reaktion beteiligten Reaktanten abhängt. Reaktionen zweiter Ordnung hingegen sind chemische Reaktionen, bei denen die Reaktionsgeschwindigkeit von der molaren Konzentration von zwei der Reaktanten oder der zweiten Leistung eines Reaktantens an der Reaktion abhängt. Der Schlüsselunterschied zwischen Phasenübergang in erster und zweiter Ordnung besteht darin, dass Phasenübergänge erster Ordnung von der ersten Leistung der Reaktantenkonzentration in einer Geschwindigkeitsgleichung abhängen, während Phasenübergänge zweiter Ordnung von der zweiten Leistung der Konzentration in der Geschwindigkeitsgleichung abhängen.
Referenz:
1. „Übergang des Auftragsphase.” Ein Überblick | Sciencedirect -Themen.
Bild mit freundlicher Genehmigung:
1. "Phase-diag2" von Matthieumarechal (CC BY-SA 3.0) über Commons Wikimedia


