Was ist der Unterschied zwischen Voltaikzelle und Elektrolytzelle
Der Schlüsselunterschied zwischen Voltaikzelle und Elektrolytzelle ist, dass eine Voltaikzelle die Energie verwendet, die während einer spontanen Redoxreaktion freigesetzt wird, um Elektrizität zu erzeugen.
Volta -Zellen oder galvanische Zellen und Elektrolytzellen sind zwei wichtige Begriffe in der Elektrochemie. Elektrochemie kann als Untersuchung der Beziehung zwischen Strom und chemischen Reaktionen beschrieben werden. Es gibt zwei Arten von elektrochemischen Zellen; Sie sind Volta -Zellen und Elektrolytzellen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine Voltaikzelle
3. Was ist eine elektrolytische Zelle
4. Volta -Zelle gegen elektrolytische Zelle in tabellarischer Form
5. Zusammenfassung -Voltaikzelle gegen Elektrolytzelle
Was ist eine Voltaikzelle?
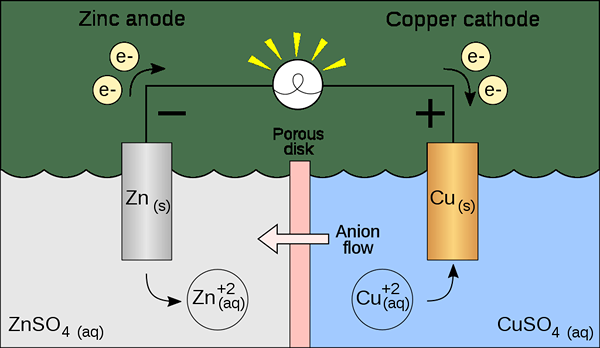
Eine Voltaikzelle ist eine Art elektrochemischer Zelle, die spontane Redoxreaktionen verwendet, um elektrische Energie zu erzeugen. Es ist auch als als bekannt Galvanische Zelle. Die Zelle enthält zwei Halbzellen. Jede Halbzelle enthält eine Elektrode und einen Elektrolyten. Die Elektrode sollte in die elektrolytische Lösung eingetaucht sein. Manchmal sind diese Elektrolyte vollständig getrennt, aber manchmal werden sie nur durch eine poröse Barriere getrennt. Wenn die Elektrolyte vollständig getrennt sind, müssen wir eine Salzbrücke verwenden, um die Bewegung von Ionen zwischen den beiden Elektrolyten aufrechtzuerhalten.

Abbildung 01: eine Voltaikzelle
Bei der Vorbereitung dieser Zelle müssen wir überlegen, ob die Elektroden und Elektrolyte spontan sind oder nicht. Wir können es theoretisch finden, indem wir die Elektrodenpotentiale jeder halben Zelle berechnen. Eine halbe Zelle sollte jedoch eine Oxidation zeigen, während die andere Halbzelle eine Reduktionsreaktion aufweisen sollte. Oxidation tritt bei der Anode auf, während bei der Kathode eine Reduktion auftritt. Da eine galvanische (voltaische) Zelle die Energie verwendet, die während einer spontanen Redoxreaktion freigesetzt wird, um Elektrizität zu erzeugen. Sie erzeugen direkten Strom.
Was ist eine elektrolytische Zelle?
Eine elektrolytische Zelle ist eine Vorrichtung, in der elektrische Energie in chemische Energie umgewandelt wird oder umgekehrt. Diese Art von Zelle enthält normalerweise zwei metallische oder elektronische Leiter, die voneinander unterscheiden und mit einem Elektrolyten in Kontakt stehen, der typischerweise gelöst oder in ionischen Verbindungen fusioniert ist.
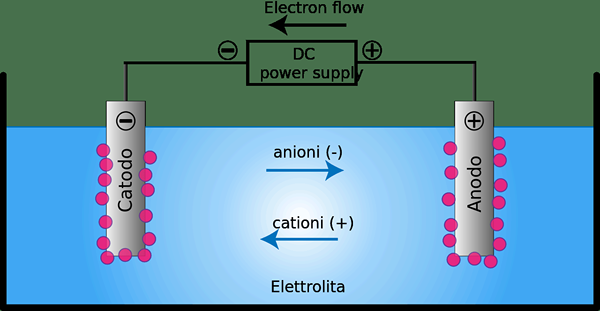
Abbildung 02: eine elektrolytische Zelle
Wir können elektrolytische Zellen als elektrochemische Zellen verwenden, mit denen Elektrolyse in bestimmten Verbindungen auftritt. Für e.G. Das Wasser der Elektrolyse kann gasförmiger Sauerstoff und gasförmiger Wasserstoff bilden. Dieses Gerät verwendet einen elektrischen Strom, um thermodynamisch ungünstige Redoxreaktionen zu fahren. Darüber hinaus tritt eine Oxidation an der Anode auf, während die Reduktion bei der Kathode auftritt.
Was ist der Unterschied zwischen Voltaikzelle und Elektrolytzelle?
Die Begriffe Voltaische Zelle (galvanische Zelle) und Elektrolytzelle sind für die Produktion von Elektrizität sehr wichtig. Der Schlüsselunterschied zwischen Voltaikzelle und Elektrolytzelle besteht darin, dass eine Voltaikzelle die Energie verwendet, die während einer spontanen Redoxreaktion freigesetzt wird, um Elektrizität zu erzeugen. Bei der Betrachtung ihrer Energiefreisetzung leiten Voltaic-Zellen Energie von spontanen Redoxreaktionen ab, während elektrolytische Zellen nicht-spontane Reaktionen beinhalten und daher externe Elektronenquellen wie Gleichstrombatterien von Wechselstromquellen erfordern.
Die folgende Tabelle fasst den Unterschied zwischen Voltaikzelle und elektrolytischer Zelle zusammen.
Zusammenfassung -Voltaikzelle gegen Elektrolytzelle
Volta -Zellen und Elektrolytzellen sind zwei wichtige Begriffe in der Elektrochemie. Der Schlüsselunterschied zwischen Voltaikzelle und Elektrolytzelle besteht darin, dass eine Voltaikzelle die Energie verwendet, die während einer spontanen Redoxreaktion freigesetzt wird, um Elektrizität zu erzeugen.
Referenz:
1. „Elektrochemie (Artikel).” Khan Akademie.
Bild mit freundlicher Genehmigung:
1. „Galvanische Zelle ohne Kationfluss“ von Original: Ohiostandard Vector: Anticompositenumber - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Elektrolytische Zellladung" durch Rodez2 - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


