Was ist der Unterschied zwischen Polarisierbarkeit und Dipolmoment
Der Schlüsselunterschied zwischen Polarisierbarkeit und Dipolmoment ist, dass Polarisierbarkeit das Maß dafür ist, wie mühelos eine Elektronenwolke durch ein elektrisches Feld verzerrt wird, während das Dipolmoment die Trennung positiver und negativer Ladungen in einem System ist.
Polarisierbarkeit und Dipolmoment sind zwei wichtige Begriffe in der Chemie, die in Bezug auf Atome, Moleküle und ihre Elektronenwolken beschrieben werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Polarisierbarkeit
3. Was ist Dipolmoment
4. Polarisierbarkeit gegenüber Dipolmoment in tabellarischer Form
5. Zusammenfassung -Polarisierbarkeit gegenüber Dipolmoment
Was ist Polarisierbarkeit?
Polarisierbarkeit kann als die Tendenz der Materie beschrieben werden. Dieses Phänomen ist eine Eigenschaft aller Materie, wenn wir der Meinung sind.
In Gegenwart eines elektrischen Feldes unterliegen negativ geladene Elektronen und positiv geladene Atomkerne. Die Polarisierbarkeit ist für die Dielektrizitätskonstante des Materials und den Brechungsindex verantwortlich, wenn hohe Frequenzen berücksichtigt werden.
Darüber hinaus ist die Polarisierbarkeit eines Atoms oder eines Moleküls das Verhältnis des induzierten Dipolmoments und des lokalen elektrischen Feldes. Wenn ein kristalliner Feststoff berücksichtigt wird, können wir das Dipolmoment pro Zelle der Einheit identifizieren. Darüber hinaus kann das lokale elektrische Feld durch ein Molekül beobachtet werden, das sich im Allgemeinen vom makroskopischen elektrischen Feld unterscheidet, können wir extern messen.
In ähnlicher Weise bezieht sich die magnetische Polarisierbarkeit auf die Tendenz des magnetischen Dipolmoments, im Verhältnis zu einem externen Magnetfeld zu erscheint. Elektrische Polarisierbarkeit und magnetische Polarisierbarkeit bestimmen die dynamische Reaktion eines gebundenen Systems auf externe Felder und geben Einblick in die innere Struktur des Moleküls.
Was ist Dipolmoment?
Ein Dipolmoment kann als Trennung von elektrischen Ladungen beschrieben werden. Die Ladungstrennung kann zwischen zwei Ionen in einer ionischen Bindung oder zwei Atomen in einer kovalenten chemischen Bindung stattfinden. Ein Dipolmoment ergibt sich aus Unterschieden zwischen den Elektronegativitätswerten verschiedener Atome, die chemische Bindungen bilden. Je größer die Differenz zwischen den Elektronegativitätswerten ist, desto größer ist das Dipolmoment umso größer. Das Dipolmoment misst die Polarität eines Moleküls. Das Dipolmoment eines Moleküls wird unter Verwendung der folgenden Gleichung berechnet.
μ = σq.R
μ ist das Dipolmoment, q ist die Ladungsgröße und R die Position der Ladung. Hier sind μ und R Vektoren, die Größen mit einer Richtung sowie einer Größe haben.

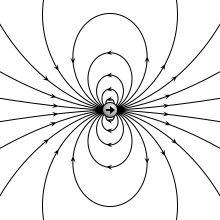
Abbildung 01: elektrisches Feld eines elektrischen Dipols
Aber manchmal wird der Begriff Dipolmoment verwendet, um das Maß für die magnetische Polarität eines Ladesystems zu nennen. Das magnetische Dipolmoment bestimmt das Drehmoment, das ein Magnet in einem externen Magnetfeld erfährt. (Drehmoment = Moment; eine Rotationskraft).
Was ist der Unterschied zwischen Polarisierbarkeit und Dipolmoment?
Polarisierbarkeit und Dipolmoment sind zwei wichtige Begriffe. Der Hauptunterschied zwischen Polarisierbarkeit und Dipolmoment besteht darin, dass Polarisierbarkeit das Maß dafür ist.
Die folgende Tabelle fasst den Unterschied zwischen Polarisierbarkeit und Dipolmoment zusammen.
Zusammenfassung -Polarisierbarkeit gegenüber Dipolmoment
Polarisierbarkeit ist die Tendenz der Materie, ein elektrisches Dipolmoment proportional zum angelegten Feld zu erwerben, wenn ein elektrisches Feld angewendet wird, während das Dipolmoment die Trennung von elektrischen Ladungen ist. Der Hauptunterschied zwischen Polarisierbarkeit und Dipolmoment besteht darin, dass Polarisierbarkeit das Maß dafür ist.
Referenz:
1. „Polarisierbarkeit.” Chemie -Libretexten, Libretexten, 4. Mai 2022.
Bild mit freundlicher Genehmigung:
1. "VFPT Dipole Animation Electric" von Geek3 - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


