Unterschied zwischen alkalischen Metallen und alkalischen Erdmetallen
Der Schlüsselunterschied Zwischen alkalischen Metallen und alkalischen Erdmetallen ist das Alle Alkali -Metalle haben ein Elektron in ihrer äußersten Hülle, während alle alkalischen Erdmetalle zwei äußere Elektronen haben.
Da sowohl Alkali -Metalle als auch Alkali -Erdmetalle die ersten beiden Gruppen in der Periodenzüchter sind. Alkali-Metalle und alkalische Erdmetalle sind die „S-Block“ -Arement.
Sowohl Alkali -Metalle als auch alkalische Erdmetalle sind gute Elektro- und Wärmeleiter. Die Elemente in diesen beiden Gruppen sind die reaktivsten Metalle in der Periodenzüchtertabelle. Ihre Schmelzpunkte sind relativ niedriger als andere Metalle. Alkali -Metalle und alkalische Erdmetalle haben viele ähnliche Eigenschaften, aber in diesem Artikel wird hauptsächlich ihre Unterschiede erörtert.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Alkali -Metalle
3. Was sind alkalische Erdmetalle
4. Seite an Seitenvergleich - Alkali -Metalle gegen alkalische Erdmetalle in tabellarischer Form
5. Zusammenfassung
Was sind Alkali -Metalle?
Die Alkali -Metalle sind die Elemente, die in der ersten Gruppe der Periodenzüchter vorhanden sind. Sie sind Lithium (Li), Natrium (Na), Kalium (K), Rubidium (RB), Cäsium (CS) und Francium (FR). Sie sind alle Metalle und sehr reaktiv, daher tritt keine dieser Metalle nicht als freie Metalle in der Natur auf. Wir sollten diese Metalle immer in träge Flüssigkeiten wie Kerosin aufbewahren, da sie schnell mit Luft, Wasserdampf und Sauerstoff in der Luft reagieren. Manchmal reagieren sie explosionsartig mit anderen Substanzen. Sie können den edlen Gaszustand leicht erreichen, indem sie das äußerste Elektron in der Valenzschale entfernen.
Die Dichten von Lithium und Natrium sind geringer als die Dichte des Wassers. Die anderen Elemente sind jedoch dichter als Wasser. Viele von Alkali -Metallverbindungen (NaCl, Kcl, NA2CO3, NaOH) sind kommerziell sehr wichtig.
Was sind alkalische Erdmetalle?
Alkalische Erdmetalle befinden sich in der zweiten Gruppe des Periodensystems. Elemente der Gruppe II umfassen; Beryllium (BE), Magnesium (Mg), Calcium (CA), Strontium (SR), Barium (BA) und Radium (RA). Ähnlich wie bei alkalischen Metallen treten diese Elemente auch in der Natur nicht frei und sind auch sehr reaktiv.

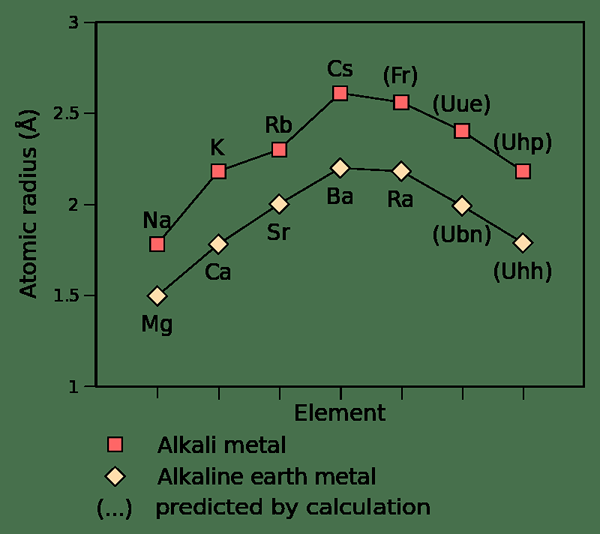
Abbildung 01: Atomradius von Alkali und Alkali -Erdmetallen
Alle Elemente in dieser Gruppe sind dichter als Wasser. Reine Metalle haben eine silbergraue Farbe, aber sie neigen dazu, sich schnell zu entfärben, wenn sie Luft ausgesetzt sind, weil sie eine Oxidschicht auf der Oberfläche bilden. Gleich wie Alkali -Metalle sind diese Metalle auch gute Leiter bei Wärme und Elektrizität. Alle diese Metalle sind kommerziell wertvoll.
Was ist der Unterschied zwischen alkalischen Metallen und alkalischen Erdmetallen?
Alkali -Metalle sind die Elemente, die in der ersten Gruppe der Periodenzüchter vorhanden sind. Alkalische Erdmetalle befinden sich in der zweiten Gruppe des Periodensystems. Alkali -Metalle haben die elektronische Konfiguration von [Noble Gas] ns1 Während alkalische Erdmetalle [Noble Gas] ns haben2 elektronische Konfiguration. In Bezug auf die Valenz dieser Metalle haben alle Alkali -Metalle ein Elektron in ihrer äußersten Hülle. Und alle alkalischen Erdmetalle haben zwei äußere Elektronen.
Alkali -Metalle haben nur +1 ionische Ladung in ihren Verbindungen, wenn alkalische Erdmetalle +2 ionische Ladungen in ihren Verbindungen haben. Im Vergleich dazu sind Alkali -Metalle reaktiver als alkalische Erdmetalle. Darüber hinaus sind Alkali -Metalle sehr weich und können mit einem scharfen Messer geschnitten werden. Alkali -Erdmetalle sind jedoch schwieriger als die Alkali -Metalle.
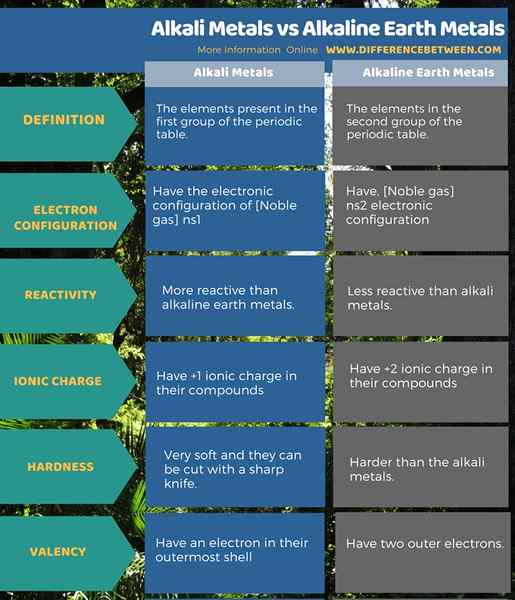
Zusammenfassung -Alkali -Metalle gegen alkalische Erdmetalle
Alkali -Metalle und die alkalischen Erdmetalle sind die Elemente der Gruppe I und der Gruppe II in der Periodenzügigkeitstabelle. Der bedeutendste Unterschied zwischen diesen beiden Gruppen ist die elektronische Konfiguration. Es bestimmt die Wertigkeit der Elemente. Der Unterschied zwischen alkalischen Metallen und alkalischen Erdmetallen besteht daher darin.
Referenz:
1. Tepper, Frederick und James L. Farbstoff. "Alkalimetall.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 21. Juni 2017. Hier verfügbar
2. "Alkalisches Erdmetall.Wikipedia, Wikimedia Foundation, 20. Mai 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Atomradius von alkalischen Metallen und alkalischen Erdmetals'by Depiep - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


