Unterschied zwischen Alkylnitrit und Nitroalkan
Der Schlüsselunterschied Zwischen Alkylnitrit und Nitro -Alkane ist das In Alkylnitrit ist die Alkylgruppe an ein Sauerstoffatom gebunden, während in Nitro -Alkan die Alkylgruppe mit dem Stickstoffatom bindet.
Obwohl die Namen Alkylnitrit und Nitro -Alkan ähnlich klingen, sind sie zwei verschiedene Arten von organischen Verbindungen. Beide Verbindungen haben in Kombination eine Nitrogruppe und eine Alkylgruppe, unterscheiden sich jedoch voneinander, basierend auf der Position, in der die beiden Gruppen aneinander verbunden werden. In Alkylnitrit befindet sich die Alkylgruppe durch das Sauerstoffatom, während sich die Alkylgruppe im Nitro -Alkan durch das Stickstoffatom befindet.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Alkylnitrit?
3. Was ist Nitro -Alkane
4. Seite für Seitenvergleich - Alkylnitrit gegen Nitroalkan in tabellarischer Form
5. Zusammenfassung
Was ist Alkylnitrit??
Alkylnitriten sind eine Gruppe organischer Verbindungen mit der Struktur R-Ono. Sie sind Alkylester von Lessrosensäure. Die kleinen Alkylnitritverbindungen sind flüchtige Verbindungen und existieren im flüssigen Zustand. Methylnitrit und Ethylnitrit (die kleinsten Alkylnitriten) sind jedoch Gase bei Raumtemperatur.
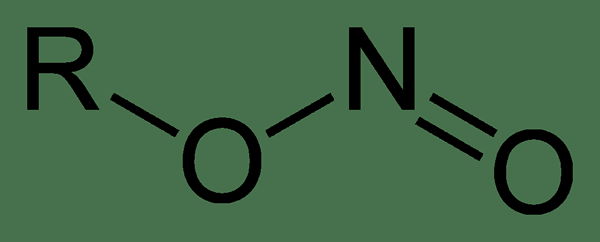
Abbildung 01: Chemische Struktur von Alkylnitrit
Abgesehen davon haben Alkylnitriten einen fruchtigen Geruch. Bei der Betrachtung der Zubereitung können wir sie aus Alkoholern und Natriumnitrit produzieren. Hier müssen wir saures Medium verwenden, meistens Schwefelsäure wird verwendet. Nach der Herstellung zersetzt sich die Verbindung jedoch dazu, zusammen mit dem Alkohol langsam in Oxide von Stickstoff und Wasser zu zersetzen. Die Hauptanwendung von Alkylnitrit ist als Medikamente; zur Erleichterung von Angina und herzbezogenen Krankheiten.
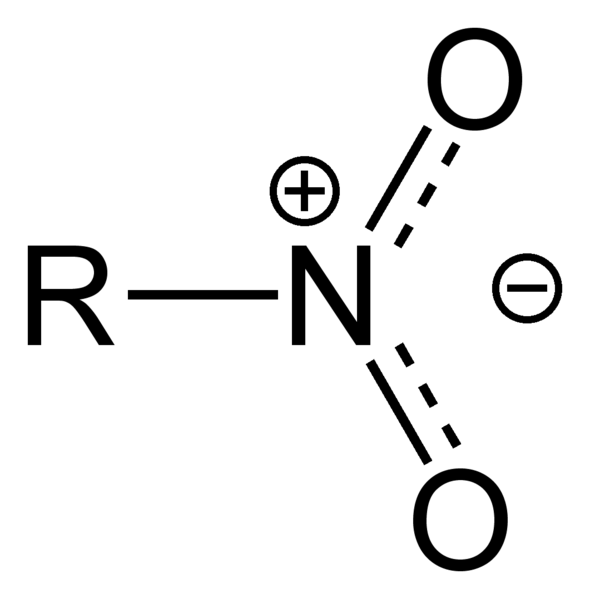
Was ist Nitro -Alkane?
Nitroalkane sind eine Gruppe organischer Verbindungen mit der Struktur R-NO2. In dieser Verbindung bindet die Alkylgruppe mit dem Stickstoffatom der Nitrogruppe. Da eine Nitro-Gruppe (-NO2) stark elektronenschwanger ist, sind die benachbarten C-H-Bindungen sauer.

Abbildung 02: Struktur des Nitro -Alkans
Normalerweise können wir Nitroalkane über freie Radikalnitrierung von Alkanen produzieren. Bei der Betrachtung der Anwendungen ist das Nitro -Alkan als wirksame Vorläufer für die Herstellung von hochsubstituierten Alkanen und Alkenen wichtig. Darüber hinaus ist diese Verbindung wichtig für die Produktion komplexer Moleküle, einschließlich Carboxsäuren, Aldehyde, Ketonen, komplexe heterocyclische Strukturen usw.
Was ist der Unterschied zwischen Alkylnitrit und Nitro -Alkane?
Obwohl die Namen Alkylnitrit und Nitro -Alkan ähnlich klingen, sind sie zwei verschiedene Arten von organischen Verbindungen. Der Schlüsselunterschied zwischen Alkylnitrit und Nitroalkan besteht darin. Alkylnitriten haben meistens einen fruchtigen Geruch, aber Nitro -Alkane hat einen charakteristischen Geruch. Darüber hinaus existieren die kleinen Alkylnitriten in der gasförmigen Phase, während andere Alkylnitriten in flüssiger Phase sind; Es gibt jedoch Nitroalkane als farblose Flüssigkeiten, die sich in eine leichte gelbe Farbe verwandeln, wenn sie einige Zeit gespeichert werden.
Bei der Betrachtung der Anwendungen sind Alkylnitriten als Medikamente gegen Herzerkrankungen und als chemische Reagenzien für die Herstellung verschiedener organischer Verbindungen nützlich. Nitroalkane sind wichtig für die Herstellung hochsutiger Alkane und Alkene, komplexe Moleküle, einschließlich Carbonsäuren, Aldehyde, Ketone, komplexe heterocyclische Strukturen usw.
Nachfolgend info-grafisch fasst der Unterschied zwischen Alkylnitrit und Nitro-Alkan zusammen.
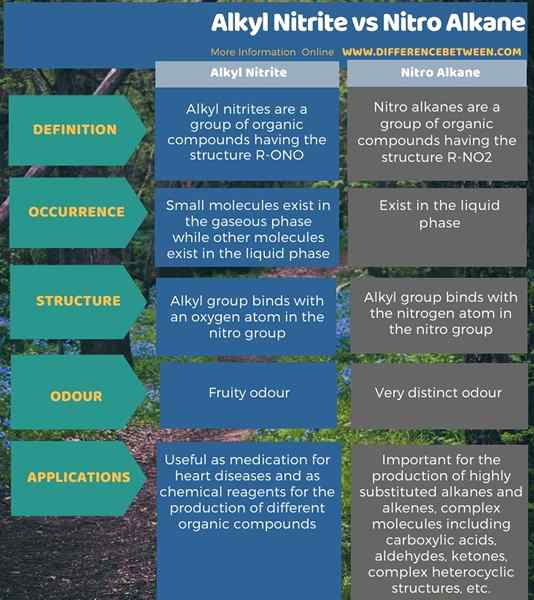
Zusammenfassung -Alkylnitrit gegen Nitro -Alkane
Obwohl die Namen Alkylnitrit und Nitro -Alkan ähnlich klingen, sind sie zwei verschiedene Arten von organischen Verbindungen. Der Schlüsselunterschied zwischen Alkylnitrit und Nitroalkan besteht darin.
Referenz:
1. „Alkylnitriten.Wikipedia, Wikimedia Foundation, 11. September. 2019, hier erhältlich.
2. “Nitro -Verbindung.”Wikipedia, Wikimedia Foundation, 20. Oktober. 2019, hier erhältlich.
3. Moldoveanu, Serban C. „Pyrolyse anderer stickstoffhaltiger Verbindungen.”Pyrolyse von organischen Molekülen, 2019, pp. 349-390., doi: 10.1016/B978-0-444-64000-0.00009-3.
Bild mit freundlicher Genehmigung:
1. "Nitrite-Eester-2d" (Public Domain) über Commons Wikimedia
2. "Nitro-Group-2D" (Public Domain) über Commons Wikimedia


