Unterschied zwischen Brom und Chlor

Der Schlüsselunterschied Zwischen Brom und Chlor ist das Brom ist weniger reaktiv als Chlor.
Halogene sind Elemente der Gruppe VII in der Periodenzüchtertabelle. Alle diese Elemente sind elektronegative Elemente und haben die Fähigkeit, -1 -Anion zu produzieren. Zu den Mitgliedern dieser Gruppe gehören Fluor, Chlor, Brom, Jod und Astatin.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Brom?
3. Was ist Chlor
4. Seite an Seitenvergleich - Brom gegen Chlor in tabellarischer Form
5. Zusammenfassung
Was ist Brom??
Brom wird durch das Symbol BR bezeichnet. Dies ist in der 4th Periode der Periodenzüchtung zwischen Chlor- und Jod -Halogenen. Die Elektronenkonfiguration beträgt [AR] 4s2 3d10 4p5. Darüber hinaus beträgt die Atomzahl von Brom 35. Seine atomare Masse beträgt 79.904. Brom bleibt als rotbraune Farbflüssigkeit bei Raumtemperatur. Es existiert als zweistiges Molekül, Br2. Darüber hinaus ist es giftig, ätzend und hat einen starken Geruch.
Die chemische Reaktivität von Brom liegt zwischen der von Chlor und Jod. Brom ist weniger reaktiv als Chlor, aber reaktiver als Jod. Es erzeugt das Bromidion durch Einnahme eines Elektrons. Daher nimmt es leicht an der Bildung der ionischen Verbindungen teil. Tatsächlich existiert Brom in der Natur als Bromidsalze anstelle von BR2. Es gibt zwei stabile Bromisotope. 79Br (50.69%) und 81Br (49.31%) sind diese Isotope.

Abbildung 01: Eine Bromprobe
Brom ist in Wasser leicht löslich, aber in organischen Lösungsmitteln wie Chloroform gut löslich, gut löslich. Es kann durch die Behandlung von Bromid-reichen Salzs mit Chlorgas hergestellt werden, sonst kann Bromgas durch die Behandlung von HBR mit Schwefelsäure produziert werden. Darüber hinaus ist es in der Industrie und in chemischen Labors von großer Bedeutung. Bromidverbindungen sind als Benzinzusatz und für Pestizide nützlich.
Was ist Chlor?
Chlor ist ein Element in der periodischen Tabelle, die wir von CL bezeichnen. Es ist ein Halogen (17th Gruppe) in der 3Rd Zeitraum der Periodenzüchter. Die Atomzahl von Chlor beträgt 17; So hat es siebzehn Protonen und siebzehn Elektronen. Die Elektronenkonfiguration beträgt 1S2 2S2 2P6 3s2 3p5. Seit der P Sublevel sollte 6 Elektronen haben, um die Konfiguration von Argon Noble Gaselektronen zu erhalten. Chlor kann ein Elektron anziehen.

Abbildung 02: Eine Probe von Chlor
Chlor hat eine sehr hohe Elektronegativität, die laut der Paulingskala etwa 3 beträgt. Darüber hinaus beträgt das Atomgewicht von Chlor 35.453 Amu. Unter Raumtemperatur existiert es als zweistiges Molekül (CL)2). Cl2 ist ein gelbgrüntes Farbgas.
Chlor hat einen Schmelzpunkt von -101.5 ° C und ein Siedepunkt von -34.04 ° C. Unter allen Chlorisotopen sind Cl-35 und Cl-37 die stabilsten Isotope. Wenn sich Chlorgas in Wasser auflöst, bildet es Salzsäure und hypochlorische Säure, die sehr sauer sind.
Chlor hat alle Oxidationszahlen, die von -1 bis +7 variieren. Außerdem ist es ein hochreaktives Gas. Es kann Brom und Jod aus Bromid- und Jodidsalz freisetzen. Daher hat es die Fähigkeit, die Anionen von Elementen, die sich unter Chlor befinden. Es kann jedoch kein Fluorid oxidieren, um Fluor zu ergeben. Chlor wird hauptsächlich durch die Elektrolyse von Natriumchloridlösungen erzeugt. Dann können wir an der Anode Chlorgas sammeln. Chlor ist als Desinfektionsmittel in der Wasserreinigung hauptsächlich wichtig. Darüber hinaus ist es nützlich bei der Herstellung einer Vielzahl von Konsumgütern wie Lebensmitteln, Insektiziden, Farben, Erdölprodukten, Kunststoff, Medikamenten, Textilien, Lösungsmitteln.
Was ist der Unterschied zwischen Brom und Chlor?
Brom ist ein chemisches Element mit der Atomzahl 35 und Symbol Br, während Chlor ein chemisches Element mit der Atomzahl 17 und Symbol CL ist. Der Schlüsselunterschied zwischen Brom und Chlor besteht darin, dass Brom weniger reaktiv ist als Chlor.
Darüber hinaus sind die Atommassen von Brom und Chlor 79.904 AMU und 35.453 AMU jeweils. Ein weiterer Unterschied zwischen Brom und Chlor besteht auch darin, dass das Brom bei Raumtemperatur als rotbrauner Farbflüssigkeit auftritt, während das Chlor als gelbgrüntes Farbgas auftritt.
Nachfolgend finden Sie eine Zusammenfassung des Unterschieds zwischen Brom und Chlor in tabellarischer Form.
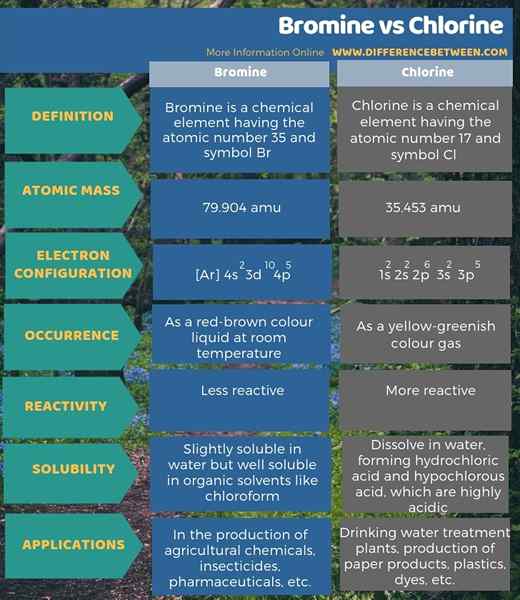
Zusammenfassung -Brom gegen Chlor
Brom ist ein chemisches Element mit der Atomzahl 35 und Symbol Br. Chlor ist ein chemisches Element mit Atomzahl 17 und Symbol CL. Zusammenfassend ist der Schlüsselunterschied zwischen Brom und Chlor, dass Brom weniger reaktiv ist als Chlor.
Referenz:
1. „Brom - Elementinformationen, Eigenschaften und Verwendung | Periodensystem.Royal Society of Chemistry - Fortschrittliche Exzellenz in den Chemiewissenschaften, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Brom -Ampoule" von Jurii - (CC von 3.0) über Commons Wikimedia
2. "Chlor-Probe" von Benjah-BMM27-eigene Arbeit (Public Domain) über Commons Wikimedia


