Unterschied zwischen hybriden und degenerierten Orbitalen
Der Schlüsselunterschied Zwischen Hybrid- und Degenerate -Orbitalen ist das Hybridorbitale sind neue Orbitale, die sich aus der Mischung von zwei oder mehr Orbitalen bilden, wohingegen degenerierte Orbitale ursprünglich in einem Atom existieren.
Wie der Name schon sagt, ist ein hybrides Orbital eine Mischung aus zwei oder mehr Orbitalen. Obwohl der Name degeneriertes Orbital gleich erscheint, sind sie keine neu gebildeten Orbitale - sie existieren bereits in einem Atom. Darüber hinaus haben alle Hybridorbitale in einem Molekül die gleiche Energie, während degenerierte Orbitale in einem Atom die gleiche Energie haben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Hybridorbitale
3. Was sind entartete Orbitale
4. Seite an Seitenvergleich - Hybrid gegen degenerierte Orbitale in tabellarischer Form
5. Zusammenfassung
Was sind Hybridorbitale?
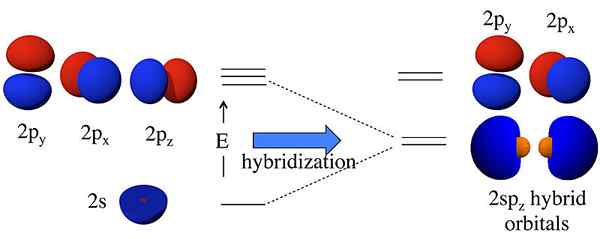
Hybridorbitale sind Orbitale, die durch die Kombination von zwei oder mehr atomaren Orbitalen gebildet werden. Wir nennen diesen Kombinationsprozess Hybridisierung. Vor der Bildung dieser Orbitale können die atomaren Orbitale unterschiedliche Energien haben, aber nach der Bildung haben alle Orbitale die gleiche Energie. Zum Beispiel kann ein S -Atom -Orbital und ein P -Atom -Orbital zu zwei SP -Orbitalen bilden. Die S- und P -Atomorbitale haben unterschiedliche Energien (Energie von s < energy of p). But, hybridization results in the formation of two sp orbitals having the same energy; this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Abbildung 01: SP -Hybridisierung
Die Idee der Hybridisierung kam zunächst in die Diskussion, weil Wissenschaftler feststellten, dass die Valenzbindungs -Theorie die Struktur einiger Moleküle wie CH nicht korrekt vorhersagt4. Obwohl das Kohlenstoffatom nach seiner Elektronenkonfiguration nur zwei ungepaarte Elektronen hat, kann es vier kovalente Bindungen bilden. Um vier Anleihen zu bilden, müssen vier ungepaarte Elektronen vorhanden sein. Die einzige Möglichkeit, dieses Phänomen zu erklären. Hier gibt ein S + drei p 4 sp3 Orbitale. Daher füllen Elektronen diese hybriden Orbitale gleichmäßig (ein Elektron pro Hybridorbital) und befolgen. Dann gibt es vier Elektronen zur Bildung von vier kovalenten Bindungen mit vier Wasserstoffatomen.
Was sind entartete Orbitale?
Verunglungsorbitale verunglimpfen die atomaren Orbitale mit der gleichen Energie. Zum Beispiel gibt es in P Orbital Subshell drei Atomorbitale, die sich je nach räumlicher Anordnung voneinander unterscheiden. Obwohl die Energie dieser drei P -Orbitale gleich ist, sind sie unterschiedlich angeordnet; Deshalb nennen wir sie entartete Orbitale.
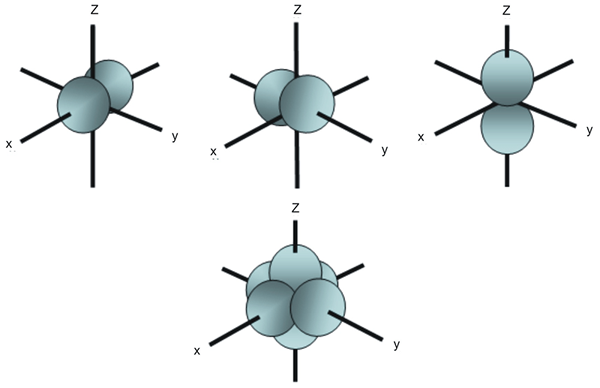
Abbildung 02: räumliche Anordnung von drei P -Orbitalen
In Gegenwart eines externen Magnetfelds können wir jedoch die Entartung entfernen. Dies liegt daran. Darüber hinaus sind fünf D -Orbitale in der D -Unterschale entartete Orbitale, weil sie die gleiche Energie haben.
Was ist der Unterschied zwischen hybriden und degenerierten Orbitalen?
Der Hauptunterschied zwischen hybriden und degenerierten Orbitalen besteht darin, dass Hybridorbitale neue Orbitale sind. Darüber hinaus sind Hybridorbitale molekulare Orbitale, während degenerierte Orbitale atomare Orbitale sind. Darüber hinaus sind Hybridorbitale molekulare Orbitale mit der gleichen Energie, während degenerierte Orbitale atomare Orbitale mit der gleichen Energie sind. Zum Beispiel sp, sp, sp, sp, sp,2 und sp3 Orbitale sind hybride Orbitale, während drei P -Orbitale in der P -Unterschale.

Zusammenfassung -Hybrid gegen degenerierte Orbitale
Hybridorbitale sind molekulare Orbitale, während degenerierte Orbitale atomare Orbitale sind. Der Hauptunterschied zwischen hybriden und degenerierten Orbitalen besteht darin, dass sich hybride Orbitale durch Mischen von zwei oder mehr Orbitalen bilden, während ursprünglich degenerierte Orbitale in einem Atom existieren.
Referenz:
1. Helmenstine, Anne Marie. „Hybrid Orbital Definition.”Thoughtco, Jun. 22, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "SP Hybridisierung" von TEM5PSU - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "PX PY PZ Orbitale" von CK -12 Foundation - Datei: High School Chemistry.PDF, Seite 268 (CC BY-SA 3.0) über Commons Wikimedia


