Unterschied zwischen Oxo und Formyl
Der Schlüsselunterschied zwischen oxo und Formyl ist, dass die Der Begriff oxo bezieht sich auf ein Sauerstoffatom, das an ein Molekül gebunden ist, während der Begriff Formyl auf eine an ein Molekül gebundene Gruppe bezieht.
OXO und Formyl sind funktionelle Gruppen in organischen Verbindungen. Daher sind dies Einheiten von organischen Molekülen. Diese funktionellen Gruppen sind normalerweise an Kohlenstoffatomen befestigt. Die chemischen und physikalischen Eigenschaften organischer Verbindungen werden durch diese funktionellen Gruppen bestimmt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Oxo
3. Was ist Formyl
4. Seite an Seite Vergleich - Oxo gegen Formyl in tabellarischer Form
5. Zusammenfassung
Was ist Oxo?
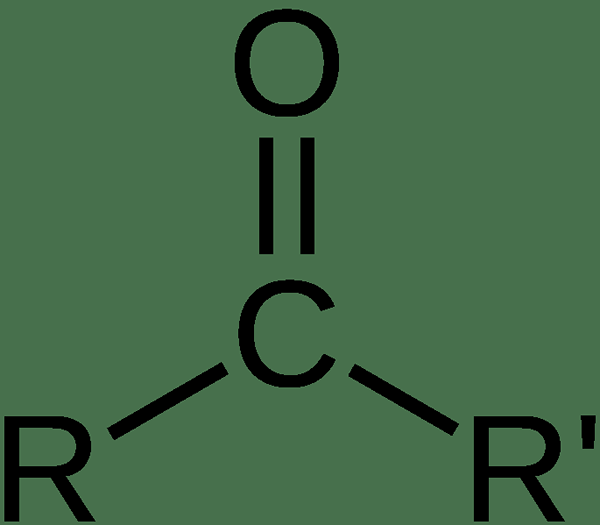
Der Begriff oxo bezieht sich auf eine funktionelle Gruppe, die ein einzelnes Sauerstoffatom enthält. Im Allgemeinen können OXO -Gruppen in Carbonylverbindungen beobachtet werden, in denen ein Sauerstoffatom durch eine Doppelbindung an ein Kohlenstoffatom bindet. Dies ist eine funktionale Gruppe, und wir können sie als "= O" abkürzen.

Abbildung 1: Die Struktur einer Carbonylverbindung mit einer oxo funktionellen Gruppe
Es gibt verschiedene Klassen von OXO -Verbindungen (Carbonylverbindungen) wie Aldehyde, Ketone, Carbonsäuren und Amide. In diesen Verbindungen ist Sauerstoff elektronegativer als das Kohlenstoffatom, an das es gebunden ist. Somit führt die OXO -Gruppe dazu, dass diese Verbindungen Resonanz zeigen. Die Fähigkeit zur Bildung von Resonanzstrukturen kann die Reaktivität des Moleküls beeinflussen. Die C = O -Bindung in der OXO -Gruppe ist eine polare Bindung, und die hohe Elektronegativität von Sauerstoffatom führt dazu. Daher wird die an die OXO -Gruppe befestigten Kohlenstoffatome zu einem Elektrophilen.
Was ist Formyl?
Formyl ist eine funktionelle Gruppe mit der chemischen Formel -Ch. Diese funktionale Gruppe enthält ein Carbonylzentrum. Wenn eine R -Gruppe an diese funktionale Gruppe angeschlossen ist, nennen wir sie als Aldehyd. Die R -Gruppe kann aliphatisch oder aromatisch sein; Normalerweise ist es eine Alkylgruppe. Beispielsweise ist die einfachste Verbindung, die eine Formylgruppe enthält, Formaldehyd. Es handelt sich um eine Aldehydverbindung, die aus der Formylgruppe besteht, die an ein Wasserstoffatom gebunden ist. Die chemische Formel von Formaldehyd ist HCOH.
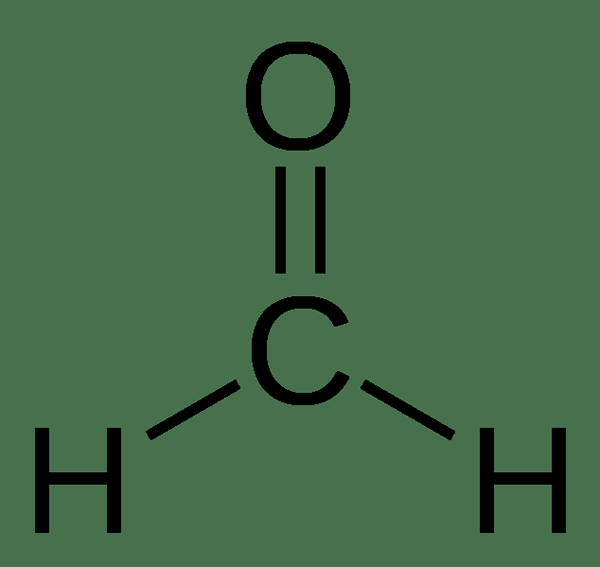
Abbildung 02: Formaldehyd enthält eine Formylgruppe, die mit einem Wasserstoffatom gebunden ist
Eine Formylgruppe tritt immer am Terminus eines Moleküls auf. Es kann nicht in der Mitte eines Moleküls auftreten (da ein Ende der Formylgruppe ein Wasserstoffatom enthält, das keine andere Bindung als seine einzelne Bindung mit dem Carbonyl -Kohlenstoffatom bilden kann).
Normalerweise ist die Formylgruppe hochreaktiv. Daher nimmt es tendenziell an vielen Reaktionen teil. E.G. Kondensationsreaktionen. Bei der Verringerung der Formylgruppe bildet es einen primären Alkohol. In ähnlicher Weise oxidiert es bei Oxidation leicht zu Carboxylsäuren zu bilden.
Was ist der Unterschied zwischen Oxo und Formyl?
Der Schlüsselunterschied zwischen Oxo und Formyl besteht darin, dass der Begriff oxo auf ein an ein Molekül gebundenes Sauerstoffatom bezieht. Darüber hinaus tritt eine OXO -Gruppe immer im mittleren Teil des Moleküls auf, während eine Formylgruppe immer im Terminus des Moleküls auftritt.
Die folgende Tabelle fasst den Unterschied zwischen Oxo und Formyl zusammen.
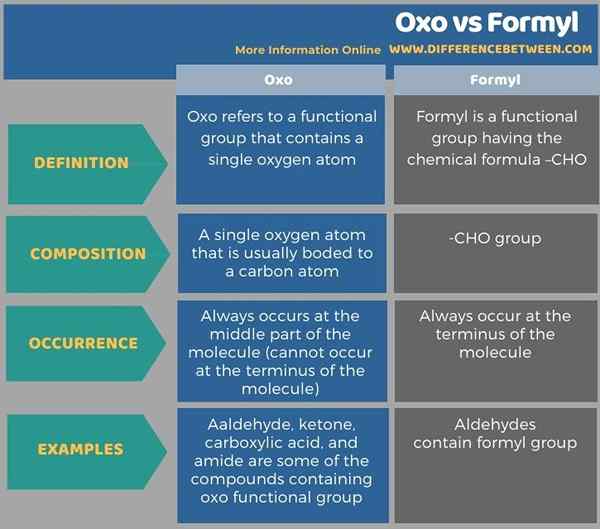
Zusammenfassung -Oxo vs Formyl
OXO und Formyl sind funktionelle Gruppen in organischen Molekülen. Der Schlüsselunterschied zwischen Oxo und Formyl besteht darin, dass der Begriff oxo auf ein an ein Molekül gebundenes Sauerstoffatom bezieht.
Referenz:
1. „Chemische Foren: Organische Nomenklatur (warum eine Gruppe als Keyton behandeln, nicht als Aldehyde?) ". Chemisches Forum, 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Keton -General" von Nothingserious - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Formaldehyde -2D" von Weron - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia


