Was ist der Unterschied zwischen äquivalenter Leitfähigkeit und molarer Leitfähigkeit
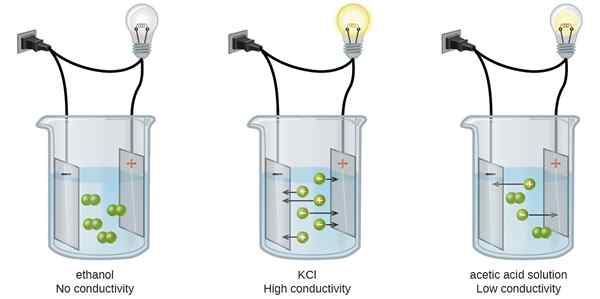
Der Schlüsselunterschied zwischen äquivalenter Leitfähigkeit und molarer Leitfähigkeit ist, dass äquivalente Leitfähigkeit die Leitfähigkeit eines Elektrolyten ist, der durch die Anzahl der Äquivalente des Elektrolyten pro Volumeneinheit geteilt wird, während die molare Leitfähigkeit eines Elektrolyt.
Molienleitfähigkeit ist die Leitfähigkeit aller Ionen, die durch einen Mol eines Elektrolyten, das in einem bestimmten Volumen der Lösung vorhanden ist. Äquivalente Leitfähigkeit ist die Leitfähigkeit eines Volumens einer Lösung, die aus einem äquivalenten Gewicht der gelösten Substanz besteht, wenn sie zwischen zwei parallelen Elektroden platziert wird.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine gleichwertige Leitfähigkeit
3. Was ist molare Leitfähigkeit
4. Äquivalente Leitfähigkeit gegenüber Leitfähigkeit in tabellarischer Form
5. Zusammenfassung -äquivalente Leitfähigkeit gegen molare Leitfähigkeit
Was ist eine gleichwertige Leitfähigkeit?
Äquivalente Leitfähigkeit ist die Leitfähigkeit eines Volumens einer Lösung, die aus einem äquivalenten Gewicht der gelösten Substanz besteht, wenn sie zwischen zwei parallelen Elektroden platziert wird. Die Elektroden werden mit einem Abstand von 1 cm zwischen ihnen platziert. Es ist groß genug, um die Lösung zwischen ihnen einzudämmen. Es kann als die Nettoleitfähigkeit jedes Ions beschrieben werden, das aus 1 Gramm Äquivalent einer bestimmten Substanz erzeugt wird. Die Berechnung für diesen Parameter erfolgt wie folgt:
λ = kv
In dieser Gleichung ist λ eine äquivalente Leitfähigkeit, k ist eine Konstante, und V ist das Volumen in Millilitern, die für 1 Gramm Äquivalent des Elektrolyts, den wir für diese Bestimmung verwenden.

Was ist molare Leitfähigkeit?
Molienleitfähigkeit ist die Leitfähigkeit aller Ionen, die durch einen Mol eines Elektrolyten, das in einem bestimmten Volumen der Lösung vorhanden ist. Der Begriff molare Leitfähigkeit bezieht sich auf die Eigenschaft einer molaren Leitfähigkeit.
Die molare Leitfähigkeit ist die Leitfähigkeit einer elektrolytischen Lösung, die gemessene Molkonzentration der Lösung gemessen wird. Wir können dies als Leitfähigkeit der elektrolytischen Lösung geteilt durch die molare Konzentration des Elektrolyten bestimmen. Daher können wir die molare Leitfähigkeit in der folgenden Gleichung geben:
Molarenleitfähigkeit = k/c
K ist die gemessene Leitfähigkeit der elektrolytischen Lösung, und c ist die Konzentration der elektrolytischen Lösung.
Bei der Betrachtung der Messung der molaren Leitfähigkeit ist die SI -Einheit für die Messung dieser Eigenschaft Siemens -Meter quadratisch pro Maulwurf. Dann wird das Gerät als s m angegeben2 Mol-1. Am häufigsten ist das Gerät für diese Eigenschaft S CM2 Mol-1.
Was ist der Unterschied zwischen äquivalenter Leitfähigkeit und molarer Leitfähigkeit?
Molienleitfähigkeit ist die Leitfähigkeit aller Ionen, die durch einen Mol eines Elektrolyten, das in einem bestimmten Volumen der Lösung vorhanden ist. Äquivalente Leitfähigkeit hingegen ist die Leitfähigkeit eines Volumens einer Lösung, die aus einem äquivalenten Gewicht der gelösten Substanz besteht, wenn sie zwischen zwei parallelen Elektroden platziert wird. Der Schlüsselunterschied zwischen äquivalenter Leitfähigkeit und molarer Leitfähigkeit besteht darin, dass die äquivalente Leitfähigkeit die Leitfähigkeit eines Elektrolyten ist, der durch die Anzahl der Äquivalente des Elektrolyten pro Einheitsvolumen geteilt wird, während die molare Leitfähigkeit der Leitfähigkeit eines Elektrolyts durch die Anzahl der Mutterlöhne von von der Molung von der Molung von der Mol leitungsfähig ist der Elektrolyte.
Die folgende Infografik stellt die Unterschiede zwischen äquivalenter Leitfähigkeit und molarer Leitfähigkeit in tabellarischer Form für Seite für Seitenvergleich dar.
Zusammenfassung -äquivalente Leitfähigkeit gegen molare Leitfähigkeit
Äquivalente Leitfähigkeit und molare Leitfähigkeit sind zwei Arten von Leitfähigkeiten. Der Schlüsselunterschied zwischen äquivalenter Leitfähigkeit und molarer Leitfähigkeit besteht darin, dass die äquivalente Leitfähigkeit die Leitfähigkeit eines Elektrolyten ist, der durch die Anzahl der Äquivalente des Elektrolyten pro Einheitsvolumen geteilt wird, während die molare Leitfähigkeit der Leitfähigkeit eines Elektrolyts durch die Anzahl der Mutterlöhne von von der Molung von der Molung von der Mol leitungsfähig ist der Elektrolyte.
Referenz:
1. „Molkoluarleitfähigkeit.” Ein Überblick | Sciencedirect -Themen.
Bild mit freundlicher Genehmigung:
1. „Leitfähigkeit (Elektrolyt) 2“ von Karishma50 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


